COVID-19病毒在全球蔓延,事态不容乐观,医药企业也将目光聚焦到抗病毒药物的研发当中。截至2月27日,共有249项与新型冠状病毒相关的临床试验登记注册,有176个与治疗相关的临床试验正在进行中,随着病毒侵染范围的扩大,相信将会有更多的研究投入到抗病毒的研究中。
在抗病毒药物的开发策略中,抗体和疫苗的研发是重要的开发策略。在3月5日,美迪西创始人&CEO陈春麟博士就这一课题展开了深入浅出的学术讲解。
文章对陈博士的课题做了简单回顾。点击文末的“阅读原文”,即可进入视频回放链接,观看陈博士的精彩讲解!
01 抗冠状病毒抗体药物靶点和技术
以往抗体研发的主要适应症为肿瘤和免疫性疾病,新冠肺炎后,抗体药物也将重点关注在感染性疾病上的作用。
抗体疗法是预防和治疗感染性疾病的惯常做法。抗体在免疫系统中具有非常重要的角色。抗体可以直接和病毒结合,起到所谓中和作用,一旦被抗体结合做了标记,病毒在体内就会按照所形成的流程被消灭。
由于抗体制备时间长,目前针对COVID-19,全球有多家公司和研究机构正在加快推进抗体开发,以应对未来可能的再次爆发。现有近30个针对新冠病毒抗体药物正在进行临床研发。
现已确立了7个抗冠状病毒靶点,同时也是药物筛选靶点。包括:
(1)病毒配体Spike蛋白;
(2)病毒受体ACE2蛋白;
(3)病毒蛋白酶PLpro(papain-like protease);
(4)Mpro(3C-like protease,或main protease);
(5)介导病毒RNA帽子的甲基化修饰的nsp16;
(6)病毒转录复制相关的RdRp(RNA-dependent RNA polymerase;
(7)和潜在的病毒用于干扰宿主免疫的X domain蛋白。
另外新发现一个靶点丝氨酸蛋白酶TMPRSS2(Ⅱ型跨膜丝氨酸蛋白酶(TTSP)。新冠肺炎的靶点与抗癌药比较相对较少。
抗体药物经历40多年的发展,逐渐从杂交瘤、嵌合抗体,到人源化抗体等,技术逐渐成熟。
单克隆抗体药物常用的单克隆抗体制备技术包括:
(1)杂交瘤技术包括嵌合抗体制备技术;
(2)筛库包括噬菌体抗体库技术和核糖体展示技术;
(3)基因小鼠制备抗体技术;
(4)单细胞筛选技术。
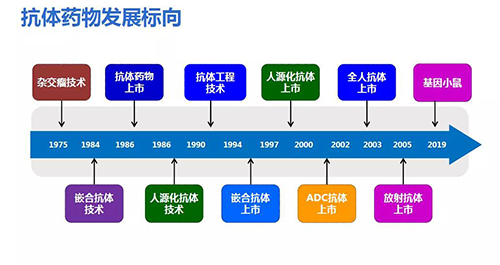
最早的淋巴细胞杂交瘤技术是通过向动物注射抗原、分离血清,得到中和抗体。现在演化为人源化细胞(如CHO)进行基因重组,通过构建载体、转染、克隆、表达、建立稳定性细胞株等系列工作,产生人源化抗体,较容易进行工业化生产。
已有几家公司可以进行基于基因小鼠制备抗体(如上海和铂医药、百奥赛图等),技术比较成熟,生产速度快。
单细胞克隆抗体发现平台如Abepic™,利用新型冠状病毒感染的肺炎康复患者血样,次日可获得近百株新冠病毒全人源抗体。
02 抗病毒ADC的开发策略
然而由于抗体药物单用效果不明显,逐渐产生了新的抗体衍生物,如抗体药物偶联物(antibody-drug conjugate,ADC)。在国内ADC药物研发技术已相对成熟。ADC包括三个部分:抗体、小分子药物、连接子。抗体到达靶细胞后,结合在细胞表面,携带的小分子进入细胞,发挥双重作用。
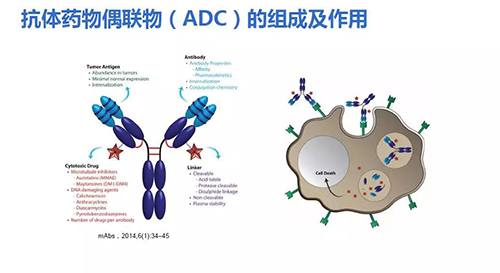
ADC经历以下发展历程:(1)抗体药物直接与小分子药物连接;(2)第二代ADC通过连接子连接抗体和小分子药物,但是为多聚物,大多数显示出较窄的治疗窗口;(3)第三代ADC呈现位点特异性偶联,药物抗体为一比一。
ADC药物适应症主要集中在抗肿瘤。抗病毒ADC药物研发可选择的小分子药大概有以下十几种。
抗病毒Payload组分列表
(1)5-取代的2‘-脱氧尿苷类似物 (如溴夫定)
(2)核苷类似物 (如恩替卡韦)
(3)焦磷酸盐类似物 (如膦甲酸钠)
(4)NRTI类药物 (如拉米夫定)
(5)NNRTIs (如奈韦拉平)
(6)蛋白酶抑制剂 (如格佐匹韦)
(7)整合酶抑制剂 (如多替拉韦)
(8)进入抑制剂 (如恩夫韦地)
(9)无环鸟苷类似物 (如更汐洛韦)
(10)无环核苷膦酸酯类似物 (如阿德福韦酯)
(11)HCV NS5A和NS5B抑制剂 (如索非布韦)
(12)流感病毒抑制剂 (如帕拉米韦)
(13)干扰素,免疫刺激剂,寡核苷酸和抗有丝分裂抑制剂
03 双抗体/三抗体的的机会
单个抗体的治疗效果有限,因此双抗和三抗也是新药研发很好的选择,双抗(双特异性抗体)已经在抗癌药物领域成功应用。双抗通常由两个不同的抗体分别与两个抗原结合,因此效果一般要好于单个抗体。美国和欧盟都已经有双抗药物获得批准上市,在中国双抗药物也已经进入临床研究阶段。
双抗的结构主要有两大类,含Fc片段(IgG-like双特异性抗体)和不含Fc片段(non-IgG-like双特异性抗体)。双抗能够识别两种不同的抗原和表位,阻断两种不同的信号通路发挥作用,因此两个抗体能够起到协同作用。双抗比普通抗体增加一个特异性抗原结合位点,通过介导免疫细胞对肿瘤的杀伤,双靶点信号阻断,具备更强的效果。
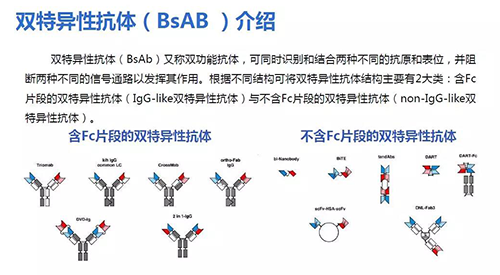
任意两种抗原都可以交联抗体变成双抗进行研究,因此组合数量很可观。抗冠状病毒有7个药物靶点,通过不同组合的变化,能够得到很多不同的双抗和三抗。这是双抗体的未来发展趋势。
04 抗体放射免疫偶联药物
除了携带小分子和双抗体以外,利用抗体携带放射性免疫偶联药物(ARC)也是很好的研究方向。这项技术目前主要应用于抗癌药物领域,抗病毒领域尚没有应用,抗体放射性免疫偶联药物对比较顽强的病毒预计会有很好的效果。
抗体放射性免疫偶联药物常用的核素很多,最常用的131I,放射性核素在细胞中能够发射连续性的辐射,引起细胞周期中放射性最敏感的 G2/M 期阻滞,阻止了靶细胞和附件细胞的DNA修复,导致癌细胞和病毒细胞死亡。ARC是抗病毒领域新药未来的发展方向。
05 抗体及其抗体衍生物的临床前研发
抗体药物的临床前研发与小分子在很多方面存在差异,例如抗体的药代动力学往往呈现非线性,组织穿透力更弱,结合位点包括清除率,通过蛋白质水解进行降解等。生物技术药物临床前研发往往面临更多的挑战与困难:
动物种属的选择,生物技术临床前研究通常在啮齿和非啮齿两个种属进行,比如食蟹猴和大鼠。即使啮齿类不表达抗体或ADC的靶抗原而被认为是非相关动物种属时,用啮齿类评估小分子脱靶毒性仍具有重要意义。评估多个不同抗体及ADC时我们观察到大鼠在评估偶联小分子脱靶毒性时与猴具有互补性。
抗体生物分析,抗体生物分析通常采用ELISA,ELISA的灵敏度高,但比小分子分析方法更加复杂,干扰因素很多,浓度与检测信号是非线性关系,误差大,需要非常小心使用。
临床前安全性评价,生物技术药物安全性评最重要的因素是选择相关的动物种属,通常非人灵长类是唯一的相关种属,如果没有相关种属时,可选择转基因模型或者替代抗体。抗体或ADC安评价需要关注免疫原性研究,遗传毒性和致癌试验一般不要求。
最后,越来越多的抗体厂家采用中美双报的申报策略,符合两国药政法规的要求需要关注以下几点。中国和美国都要求药物安全性评价符合GLP规范, 但FDA建议采用集成软件监控全程的数据采集,具有认定资格的病理学家阅片,中国尚没有要求全程监控,暂时没有要求资格认定的病理学家,有经验的病理学家即可满足中国要求。申报文件格式方面,美国申报资料要求毒理学试验转换成SEND格式,SEND是FDA研究数据的一种标准格式,中国没有要求SEND格式。
06 美迪西一站式临床前研究平台
美迪西经过16年的稳步发展,积累了丰富的对抗体及ADC等抗体衍生物的的研究和申报能力。美迪西目前拥有3个园区约30,000平方米的实验室面积,扩建后将超过7万平方米,拥有覆盖多领域的科研攻坚团队。美迪西的一站式临床前研究平台包括了从药物发现、药学研究一直到临床前研究、申报注册的服务项目,涉及化学、生物、药学、药效学、药代/毒代动力学、毒理学等多个学科。
经年来,美迪西建立了多个实力强劲的技术平台,包括蛋白质/抗体药物药代动力学平台,生物技术药物非人灵长类安全评价平台,基于动物模型的药效学平台等等,都为抗体及抗体衍生物新药研究提供了强有力的工具和手段。
除此之外,美迪西已达到全球多个国家的安全性评价平台标准,在美国、澳大利亚、欧洲等地助力多个项目获得临床批件,为国际申报积累了丰富的案例经验。
THE END
关于美迪西
美迪西(股票代码:688202)是一家药物研发外包服务公司(CRO)。成立于2004年2月2日,公司走过16个年头,在上海建立了一家集化合物合成、化合物活性筛选、结构生物学、药效学评价、药代动力学评价、毒理学评价、制剂研究和新药注册为一体的符合国际标准的综合技术服务平台,并得到了国际药品管理部门的认可。美迪西普亚的动物实验设施获得AAALAC(国际动物评估与认证协会)认证和国家药品监督管理局NMPA GLP证书,并已达到美国食品药品管理局GLP标准。
美迪西拥有丰富的全球合作经验,2015年以来,美迪西在全球服务超过500家活跃客户,已为武田制药、强生制药、葛兰素史克、罗氏制药等多家全球性制药公司及恒瑞医药、扬子江药业、石药集团、华海药业、众生药业等国内外知名客户提供研发外包服务。
联系我们
Email: marketing@medicilon.com.cn
电话: +86 (21) 5859-1500(总机)











 相关新闻
相关新闻