 新途径方法(NAMs)
新途径方法(NAMs)- 2025年4月,美国FDA宣布在单抗类药物领域逐步放弃动物试验,用其他体外技术和模型来替代动物实验,这一决策标志着基于AI、类器官等新技术的新途径方法(NAMs)正式进入药物安全评价的主流实践。以AI驱动的高精度计算机模拟机制建模和先进的体外模型为代表的NAMs正在重塑药物研发的规则。NAMs能够通过提供更具人体相关性的数据,助力企业高效、低成本地推进创新药开发,在全球竞争中领先同类药物审批,同时响应科学性、伦理性与可持续发展的要求。NAMs指不再单纯依赖于传统动物实验,而充分整合先进体外模型、计算机建模和人工智能(AI)技术、能够支持药物安全性和有效性评价的药物开发新模式,以减少乃至替代传统动物实验。高质量NAM数据通过体外(in vitro)、离体(ex vivo)和计算机模拟(in silico)实验产生,主要包括:
 先进体外实验
先进体外实验如3D细胞培养、器官芯片(Organ-on-Chip)、微生理系统(MPS)、类器官(Organoid)等,能更好模拟人体生理病理环境。
 机制建模与人工智能
机制建模与人工智能如生理药代动力学(PBPK)、定量系统药理学(QSP)、定量系统毒理学(QST)模型、免疫原性预测等,基于体外/计算数据预测人体药代、药效、剂量等。
NAMs的优势: 提高新药开发的成功率
提高新药开发的成功率NAMs能够更准确地模拟和预测人体内的药物作用机制、疗效与毒性,从而提升药物筛选和开发的科学性和成功率。
 降低动物试验的需求,减少研发成本并缩短药物上市时间
降低动物试验的需求,减少研发成本并缩短药物上市时间NAMs能够在药物安全性与有效性评估等诸多环节,提升预测准确性的同时,显著减少乃至替动物实验,大幅节约研发成本、加速药物审批,更加符合伦理及社会发展需求。
 美迪西NAMs药物研发服务平台
美迪西NAMs药物研发服务平台 核心亮点:三位一体架构
核心亮点:三位一体架构AI药物发现服务平台
美迪西AI药物发现服务平台可提供蛋白结构预测与模拟、结合位点发现、信息提取与清洗,以及定制化项目数据库构建等,满足科研工作者多样化的需求。此外,平台还深度助力 Target-to-hit、Hit-to-lead、Lead-to-PCC 等关键研发阶段,为药物研发提供了全方位的技术支持,加速药物研发管线进程。体外安全评估技术平台
 体外安全谱
体外安全谱GPCRs
核受体
离子通道
转运体
酶实验 细胞毒性
细胞毒性CellTiter Glo/LDH/MTT/CCK-8
细胞凋亡/坏死/铁死亡
HepG2、HUVEC、HEK293、SH-SY5Y等
原代肝细胞、PBMC、红细胞、血小板等 线粒体毒性
线粒体毒性ROS 检测
线粒体膜电位检测 assay 心脏毒性
心脏毒性hERG膜片钳和放射性配体结合试验
Nav1.5和Cav1.2放射性配体结合试验
iPSC衍生的心肌细胞-2D/3D细胞毒性检测 肝毒性
肝毒性肝类器官活力检测
HepG2/原代肝细胞线粒体应激-Seahorse检测
线粒体膜电位检测
ROS检测 肾脏毒性
肾脏毒性MDCK、HEK293、Vero、HK-2细胞毒性试验
原代食蟹猴、大鼠或猴肾细胞细胞毒性试验 遗传毒性
遗传毒性Mini-AMES试验
AMES试验
增强AMS试验
体外染色体畸变试验
体外微核试验 肿瘤类器官毒性
肿瘤类器官毒性已建立12个肿瘤类型、43株肿瘤类器官模型
肿瘤类器官毒性试验-CTG、LDH
肿瘤类器官转录组学研究-RNAseq
肿瘤类器官免疫组化研究 免疫毒性
免疫毒性人全血/PBMC细胞因子释放试验
T细胞增殖/活化
B细胞增殖/活化
混合淋巴反应 (MLR)
PBMC-PDXO共培养 光毒性
光毒性体外3T3细胞中性红摄取试验
 制剂安全性
制剂安全性体外溶血试验
 证据权重分析(WoE)
证据权重分析(WoE)致癌性评估的证据权重分析
幼龄动物安全性评估的证据权重分析
生殖毒性安全性评估的证据权重分析体外3D细胞培养体系-HepG2细胞
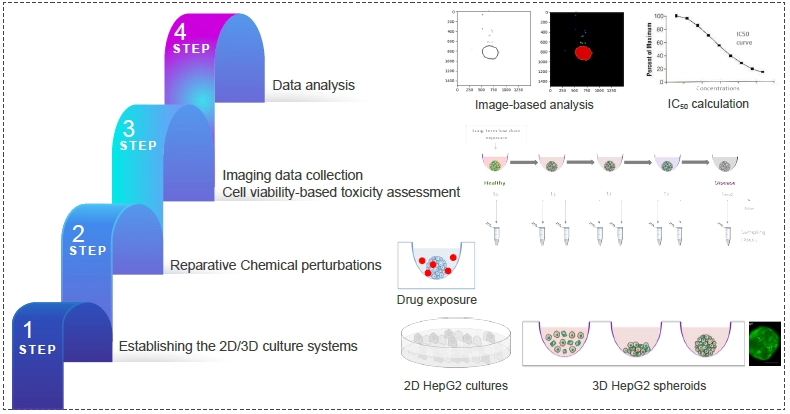
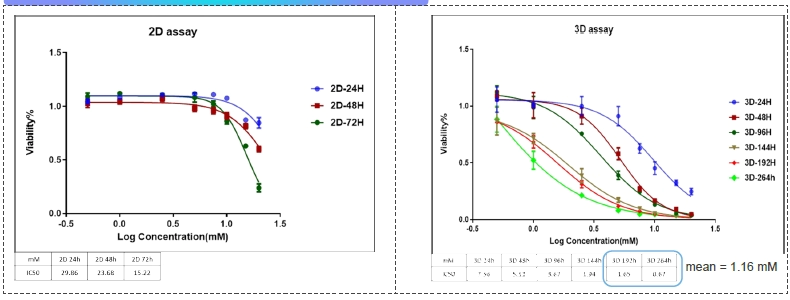
案例分享: 体外3D细胞培养体系-HepG2细胞毒性测试
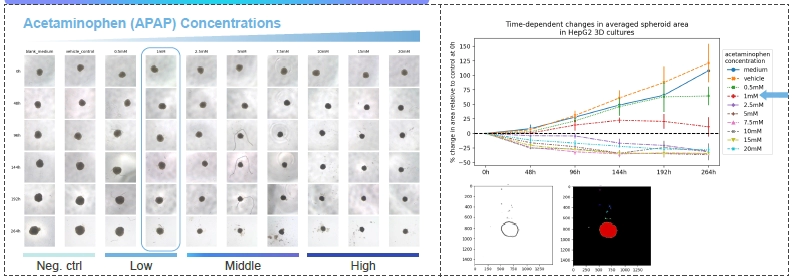
案例分享: 体外3D细胞培养体系-HepG2细胞毒性测试
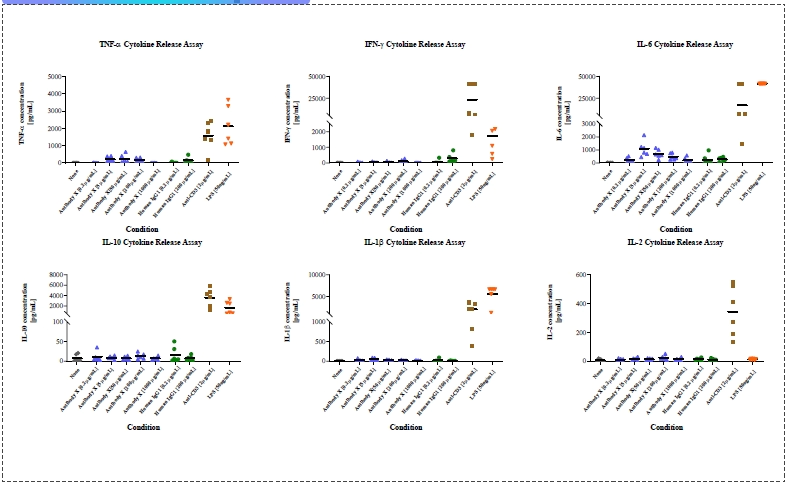
细胞因子释放实验
根据CDE在2020年发布的《药物免疫原性研究技术指导原则》,高风险免疫相关生物药(如免疫检查点抑制剂、激动剂、双抗等)在IND申报前,必须进行体外细胞因子释放试验(CRA)。该试验通常使用人外周血单个核细胞或全血,在液相或固相环境中与药物孵育,以评估其引发细胞因子风暴的风险。Experimental design Cells 3-6 donors, fresh PBMC preferred Incubation system Liquid phase and solid phase Incubation time 6h, 24h or 48h (usually two time points will be OK) Negative control Formulation buffer, PBS Isotype control (for antibody) IgG1, IgG4 Positive control Anti-CD3, LPS Routine cytokine panel 8 cytokines:IL-2, IL-6, IL-10, IFN-γ, TNF-α, IL-1β, IL-4, IL-12p70
10 cytokines:IL-2, IL-6, IL-10, IFN-γ, TNF-α, IL-1β, IL-4, IL-12p70, IL-8, IL-13设计体外细胞因子释放实验案例分享: 细胞因子释放实验 - 固相法
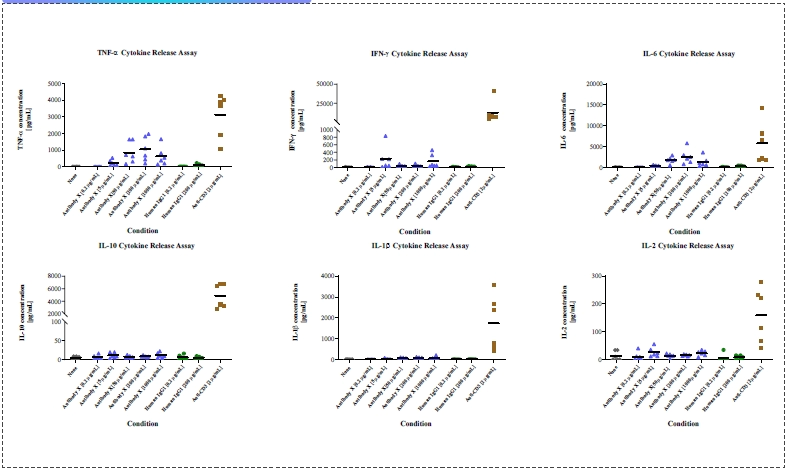
案例分享: 细胞因子释放实验 - 液相法
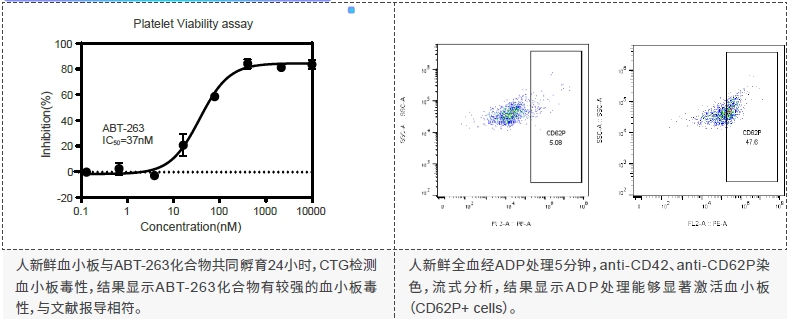
案例分享: 血小板毒性 - 血小板激活实验
案例分享: 小核酸脱靶研究 - 转录组学
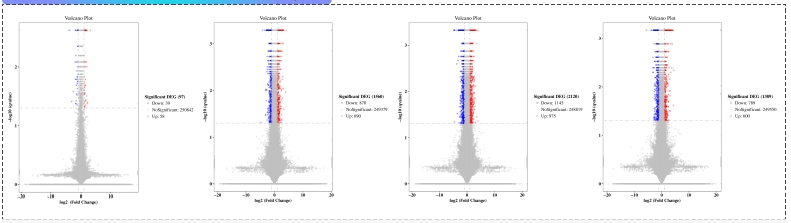 HepG2细胞转染不同的siRNA(10 nM)后,收取细胞沉淀,进行转录组测序,分析可能存在的脱靶基因。红色表示转染siRNA后,mRNA有显著上调的基因,蓝色表示有显著下调的基因,灰色表示无显著变化的基因。
HepG2细胞转染不同的siRNA(10 nM)后,收取细胞沉淀,进行转录组测序,分析可能存在的脱靶基因。红色表示转染siRNA后,mRNA有显著上调的基因,蓝色表示有显著下调的基因,灰色表示无显著变化的基因。案例分享: PROTAC脱靶研究 - 蛋白组学
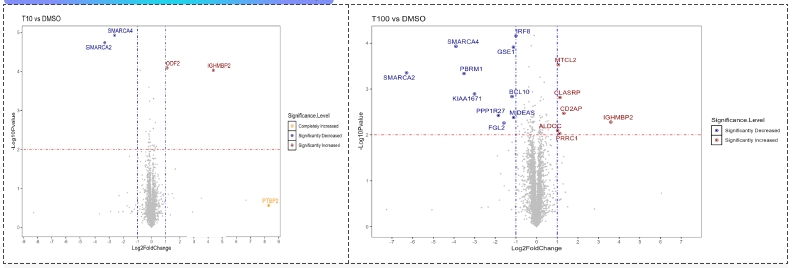 Smarca2/4 PROTAC处理MV-4-11细胞(DMSO, 10 nM, 100 nM), 图A 及 图B 显示该PROTAC在10nM条件下主要降解Smarca2以及Smarca4,而其浓度升高至100nM后有过多的脱靶现象发生。
Smarca2/4 PROTAC处理MV-4-11细胞(DMSO, 10 nM, 100 nM), 图A 及 图B 显示该PROTAC在10nM条件下主要降解Smarca2以及Smarca4,而其浓度升高至100nM后有过多的脱靶现象发生。肿瘤类器官PDXO平台
Patient-Derived Xenograft Organoid (PDXO) 模型,作为新一代肿瘤研究工具,完美契合FDA对“减少动物实验”的要求,为创新药物研发提供关键技术支持。PDXO用于体外药效评估

美迪西PDXO库
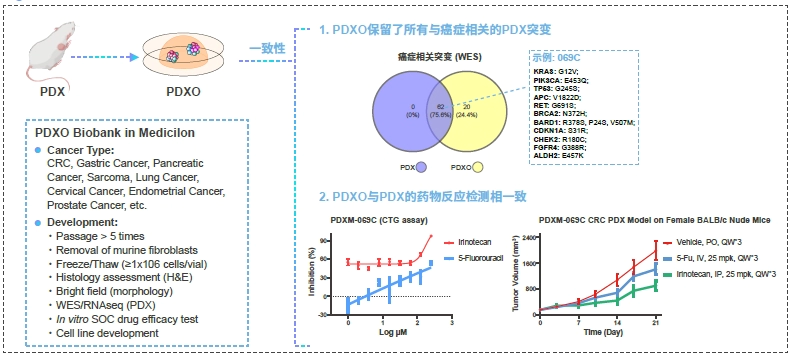
美迪西PDXO和PDXOC库
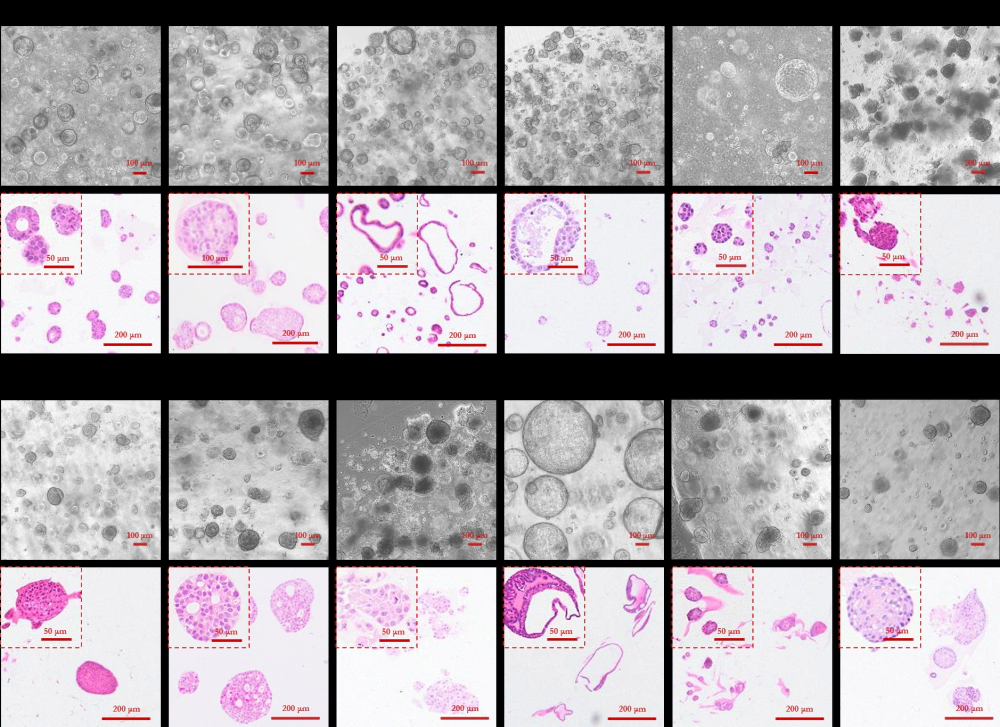
癌症类型 PDXO (肿瘤类器官) PDXOC (肿瘤细胞系) 膀胱癌 412U 238U、412U 宫颈癌 371Ce、373Ce 371Ce、373Ce 子宫内膜癌 361En 361En 食管癌 165Es 165Es、343Es 胃癌 147Ga、155Ga、157Ga、158Ga 150Ga、153Ga、155Ga、158Ga、259Ga 肠癌 062C、064C、069C、075C、102C、163C 062C、064C、 069C、102C、163C 肝癌 217Li、218Li、532Li 217Li 肺癌 170Lu、267Lu、269Lu、563Lu、564Lu 170Lu、267Lu、269Lu、563Lu、564Lu 黑色素瘤 571Me 神经母细胞瘤 391Nb 391Nb 胰腺癌 167Pa、225Pa、522Pa、523Pa、228Pa、524Pa 167Pa、225Pa、522Pa、523Pa、524Pa 前列腺癌 351Pr、355Pr 355Pr 横纹肌肉瘤 332Sa、334Sa 332Sa、338Sa、339Sa 案例分享: PDXO表征 - 明场图像和H&E染色
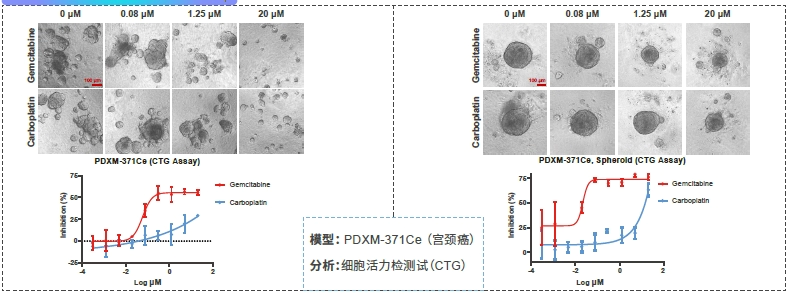
案例分享: PDXO - 药物筛选
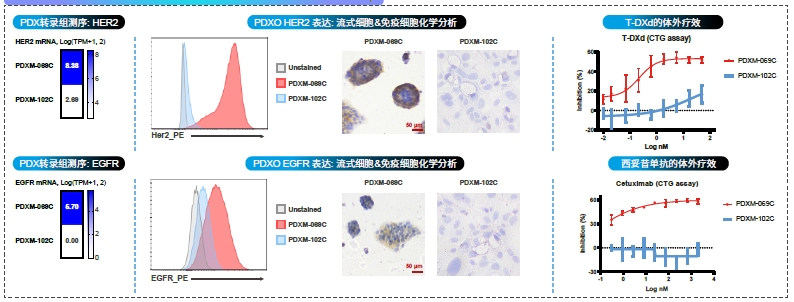
案例分享: PDXO - HER2与EGFR的多组学研究
案例分享: PBMC/PDXO共培养 - 免疫细胞毒性研究
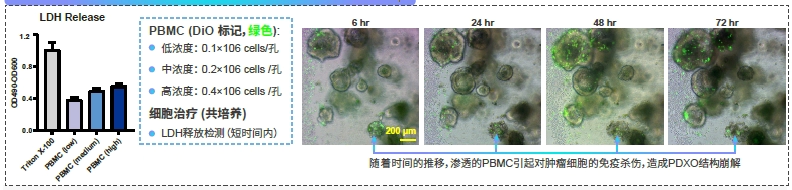 研究发现:
研究发现:
→LDH释放随着PBMC数量的增加而增强,表明抗癌免疫反应增强
→使用荧光成像进行的时间过程分析显示:PBMCs(外周血单核细胞)随着时间的推移表现出增强的浸润和杀伤效应。随着PBMC的浸润,观察到PDXO(肿瘤类器官)发生结构崩解。小鼠小肠和肝脏类器官发育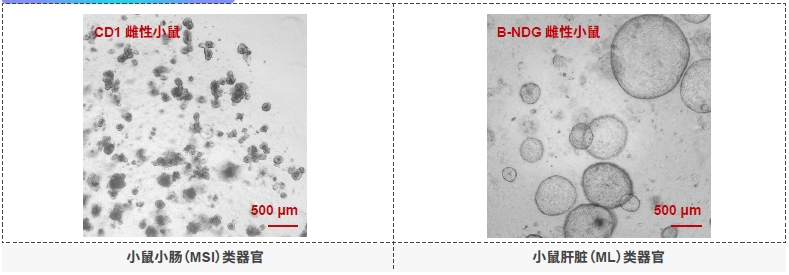
生理药代动力学PBPK平台
基于生理药代动力学PBPK模型预测人体PK
临床前种属PBPK模型搭建与ADME特点分析:
根据所提供的建模数据,用于药物临床前PBPK模型的搭建与确认,并建立可以反映临床前试验结果的PBPK模型;
药物在临床前种属体内ADME过程的特点分析;
参数敏感性分析,考察影响临床前种属PK的关键参数等。人体PBPK模型搭建并预测人体PK:
种属外推建立人体PBPK模型;
根据剂量,预测和分析人体PK;
参数敏感性分析,考察影响人体PK的关键参数等。PBPK建模预测人体PK需要的主要数据
结构式
分子量
不同pH对应的溶解度
模拟胃、肠液的溶解度,比如SGF、FaSSIF、FeSSIF
Log P(也可以提供不同pH值对应的Log D)
pKa
渗透性
各种属的血浆蛋白结合率的数据
各种属的全血血浆药物分配比
体外代谢稳定性数据(比如肝微粒体、肝细胞、重组酶的数据)
体外转运体试验数据
临床前各种属的静脉和血管外PK数据
临床前种属物质平衡的数据
 总结
总结- NAMs正在重塑全球药物研发范式,主动拥抱NAMs,不仅能与FDA等监管机构实现更高效的早期对话,更能重塑研发流程:缩短研发周期、降低研发成本,且以更精准可靠的数据支撑监管决策。











 美迪西AI技术服务平台
美迪西AI技术服务平台






