外用制剂研发
外用制剂研发
外用制剂剂型考量
适应症
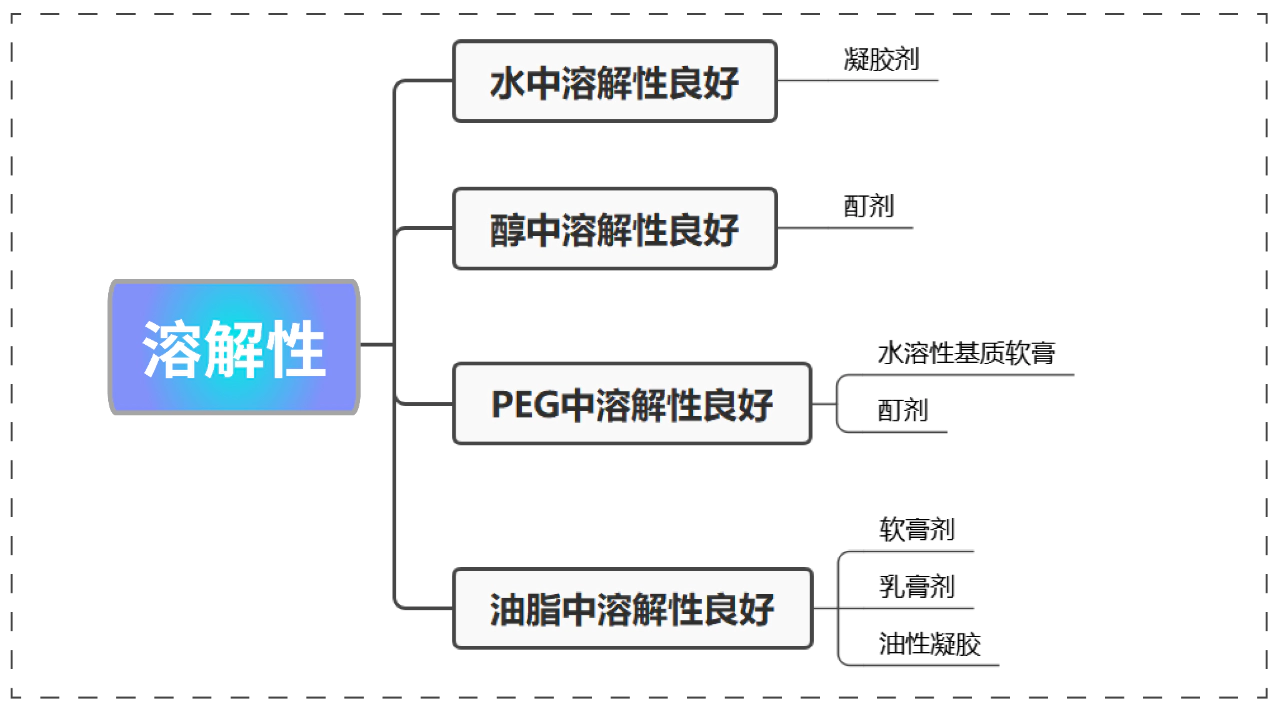
适应症 适用剂型举例 特异性皮炎 油溶性基质软膏、水溶性基质软膏、乳膏 银屑病/白癜风 软膏、乳膏、喷雾剂、泡沫剂 斑秃 搽剂、酊剂、喷雾剂、泡沫剂 荨麻疹 搽剂、喷雾剂 灰指甲 溶液剂、搽剂 风湿性关节炎 喷雾剂、凝胶剂、贴剂 痤疮 凝胶、泡沫剂 脂溢性皮炎 洗剂、泡沫剂 痔疮 栓剂、乳膏 美迪西能够开发的剂型:软膏、乳膏、凝胶、酊剂、搽剂、外用喷雾剂、气雾剂等。咨询相关服务溶解性
外用制剂原料药性质考量
原料药性质 对制剂影响 溶解性 在油和水中有适度溶解度,混悬型对制剂挑战较大。 渗透性 要求具有良好的渗透性,logP 值最好在 2 以上。
亲脂性足以穿透角质层,亲水性足以分配到真皮层。是否可以成盐 药物只能通过分子进行吸收,建议使用游离态。
如果作用于角质层,可以使用盐。熔点 低熔点,小于 200℃。 分子量 小于 500 道尔顿,高分子量化合物很难透过批次。 pKa 对于可离子化的分子,其非离子型分子的比例至关重要。
在皮肤 pH(~4–6)下主要以非离子形式存在。剂量 低,减少局部和系统暴露,提高安全性。 外用制剂关键质量属性
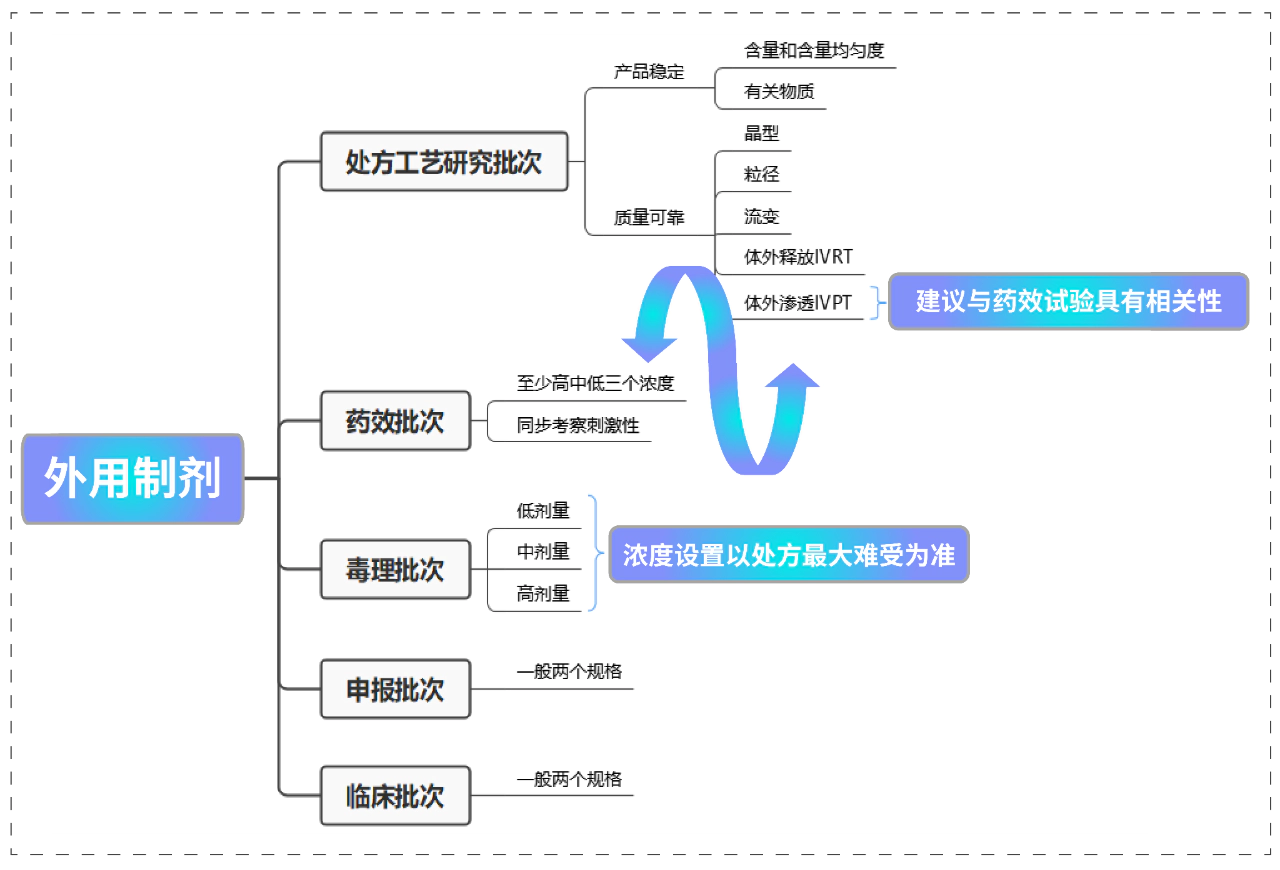
关键质量属性 是否CQAs 依据 性状 是 外观和性状通常 鉴别 是 影响安全性和有效性,可通过质量管理体系得到有效控制 有关物质 是 影响产品安全性 黏度 是 影响产品的涂布和释放,从而影响产品安全性和有效性 含量均匀度 是 影响产品安全性和有效性 微生物限度 是 影响安全性 抑菌效力 是 影响安全性 液滴粒径 是 影响安全性和有效性 流变特性 是 影响有效性 体外释放 是 主要用于产品的质量控制 体外渗透 是 反应药物制剂的质量 微观结构 是 反应制剂的微观结构,影响产品有效性 ❖ 乳膏剂、软膏剂及凝胶剂等半固体制剂:外观、混悬药物的晶型、粒度分布、液滴粒径、流变特性、pH值、黏度、含量均匀度、微生物限度、有关物质、抑菌剂含量及抗氧剂含量、无菌(用于烧伤或严重创伤的无菌制剂)以及体外释放试验(IVRT)和体外透皮试验(IVPT)等;❖ 透皮贴剂:性状、鉴别、含量、单位剂量均匀性、有关物质、剥离强度、保护层剥离力、初黏力、持黏力、冷流、体外释放试验(IVRT)、体外透皮试验(IVPT)、原料药析晶、包装完整性、残留溶剂、微生物限度(如适用)、促渗剂含量/抗氧剂含量/含水量(如适用)等;❖ 阴道/直肠制剂质量属性:性状、黏度/锥入度及流变学特性(适用于半固体)、粒度分布(混悬状态)、融变时限(适用于栓剂、软胶囊)、pH值、含量均匀度、溶出度(或释放度)、体外释放试验、体外透黏膜试验、有关物质、含量测定、微生物限度、抑菌效率、抑菌剂及抗氧剂含量、原料的晶型和粒度等。药物的释放是吸收的唯一限速步骤。推荐阅读:美迪西透皮制剂体外评价服务外用制剂的关键批次
 ❖ 对外用制剂来说,氧化降解杂质一般是其主要降解杂质,同时需要关注高温降解杂;
❖ 对外用制剂来说,氧化降解杂质一般是其主要降解杂质,同时需要关注高温降解杂;
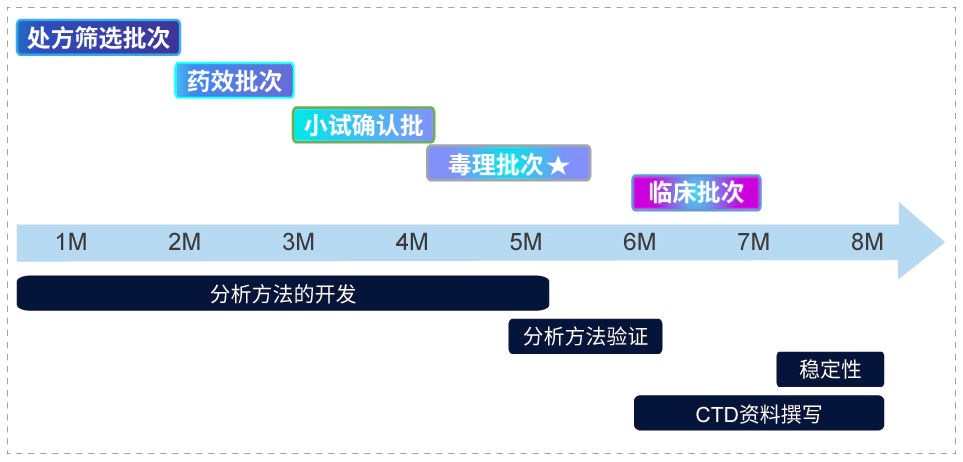
❖ 毒理批次高剂量可以是混悬制剂,低中剂量是澄清制剂。外用制剂在IND阶段的开发流程
外用制剂的处方设计关注点
❖ 安全性:无皮肤刺激性、微生物限度、抑菌效力、杂质控制、长毒试验;
❖有效性:IVRT&IVPT、药效模型、IIT试验;
❖ 稳定性:含量、晶型、粒径、流变学性质、体外释放。外用制剂工艺开发
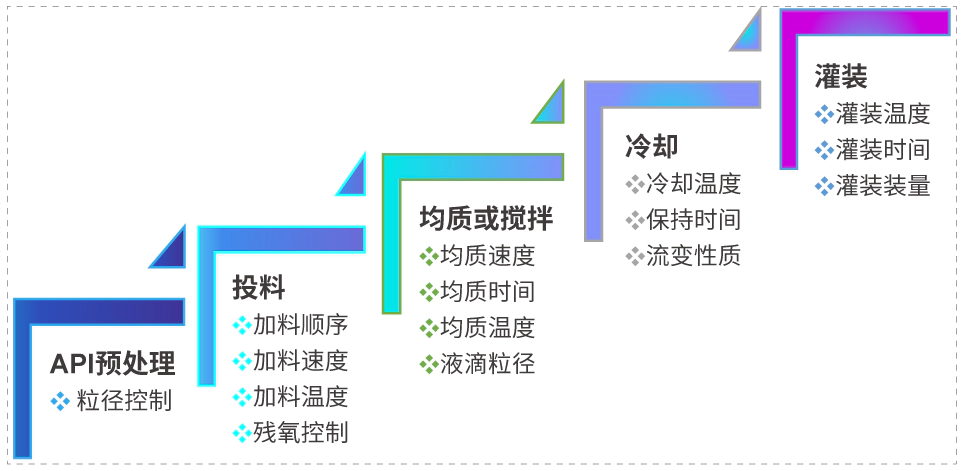
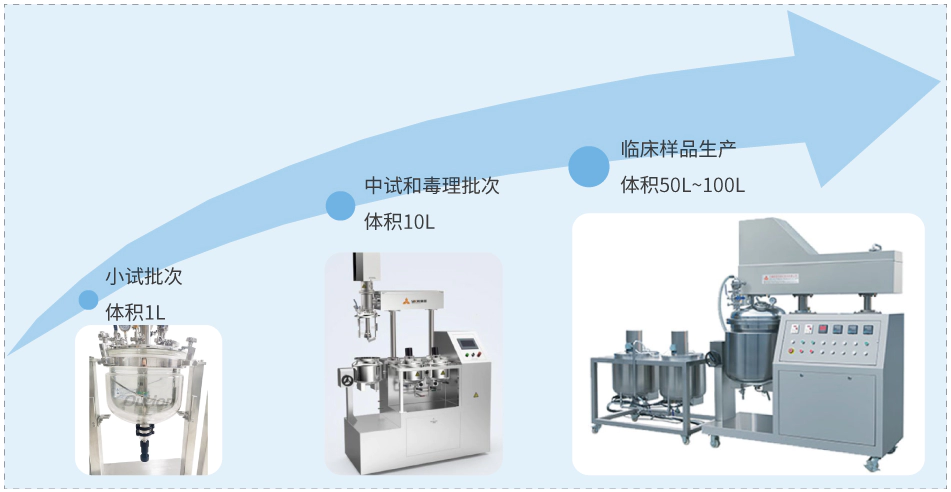
外用制剂逐级放大
用制剂质量控制
❖ API质量标准
❖ 辅料质量标准
❖ 制剂质量标准项检测
❖ 制剂质量研究项:混悬型制剂、IVRT、IVPT、流变特性、黏度、pH值
❖ 中控质量标准:性质、外观、含量均匀度、粒径、黏度等案例:某软膏剂1类新药
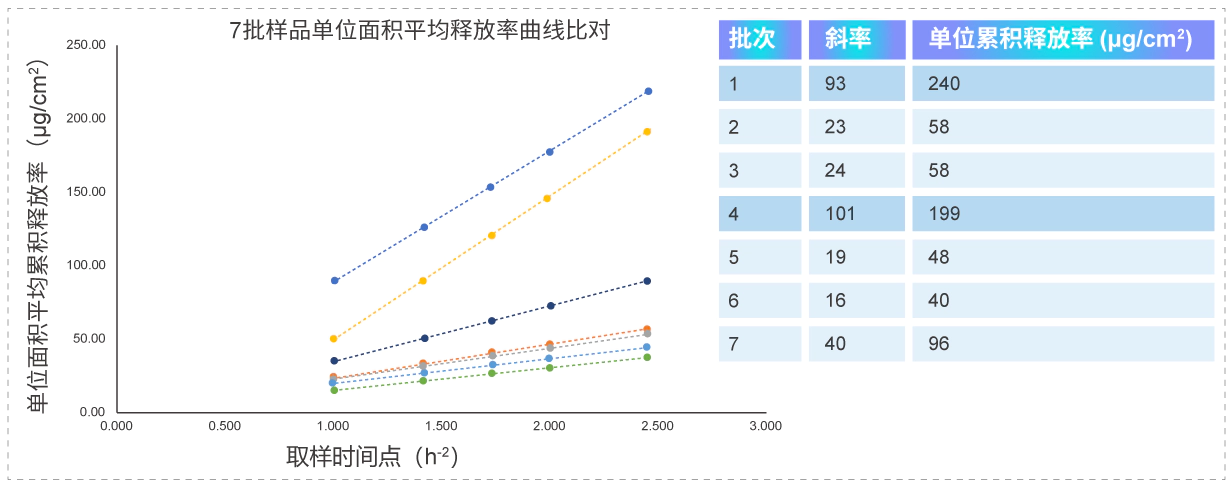 释放快即线性斜率大的批次样品,单位累积释放率高,药效结果明显,IVRT对于处方筛选有一定正向指导意义,也可用于新药初步成药性筛选研究。
释放快即线性斜率大的批次样品,单位累积释放率高,药效结果明显,IVRT对于处方筛选有一定正向指导意义,也可用于新药初步成药性筛选研究。案例:某凝胶剂仿制药
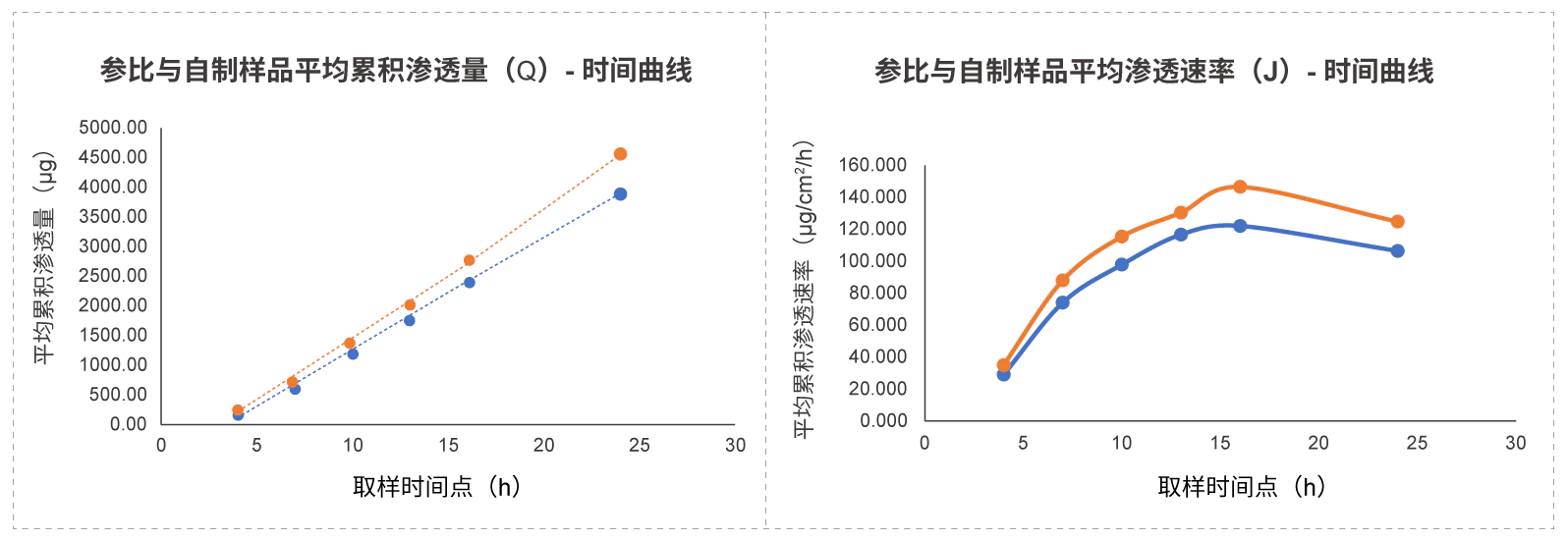 自制制剂与参比制剂渗透行为一致,满足90%置信区间的要求。
自制制剂与参比制剂渗透行为一致,满足90%置信区间的要求。美迪西外用制剂研发服务优势
❖ 深厚的研发经验:拥有专业团队与先进设备,在外用制剂领域(包括乳膏剂、软膏剂、凝胶剂、贴剂、微针等)具备丰富的仿制药与新药研发经验,多个项目已获得生产或临床批件。
❖广泛的服务范围:除皮肤给药制剂外,还涵盖眼用、阴道及侵入性给药筛选,可独立承接半固体制剂仿制药的体外等效性一致性评价,并配备半固体GMP车间,提供临床样品生产服务。
❖灵活的定制服务:根据客户需求分阶段定制研发方案,包括化合物成药性处方筛选、工艺优化与放大,紧密配合非临床研究进程。
❖严格的质量体系:遵循ICH指南与cGMP规范,符合NMPA、FDA等监管机构的注册与法规要求,满足CMC质量管理和第三方认证标准。
 外用制剂药效评价
外用制剂药效评价外用制剂药效研究模型
外用制剂药效评价动物模型特点:
❖ 单笼单养,防止动物舔舐口服影响给药准确性;
❖ 现有模型普适性经典模型,多数有成功申报经验;
❖ 考察指标紧贴临床指标。美迪西建立了多种皮肤疾病动物模型,具备全面的药效评价能力:适应症 动物模型 脱发 二氢睾酮/丙酸睾酮诱导的小鼠雄性脱发模型 斑秃 咪喹莫特/环磷酰胺诱导的小鼠斑秃模型 银屑病 咪喹莫特/IL-23诱导的银屑病模型 特应性皮炎 伏波酯/DNFB诱导的特应性皮炎模型 瘙痒 化合物48/80诱导小鼠急性瘙痒模型 皮肤创伤 大鼠皮肤烫伤模型 糖尿病足 糖尿病足药效学模型 案例:咪喹莫特诱导的银屑病
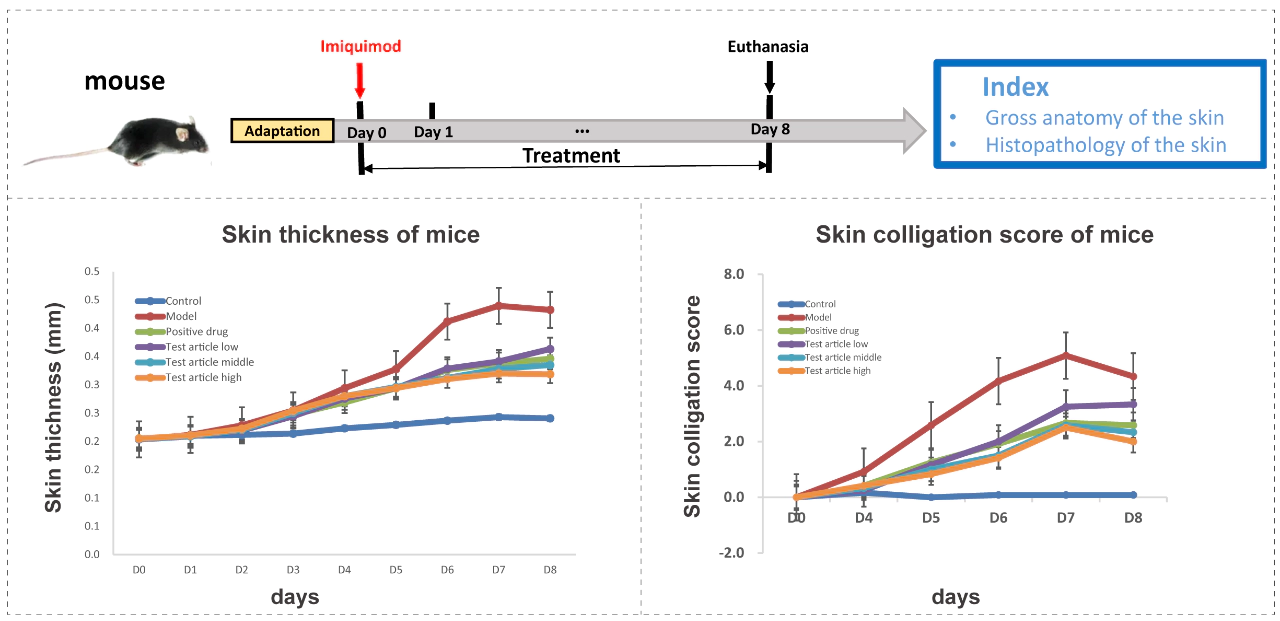
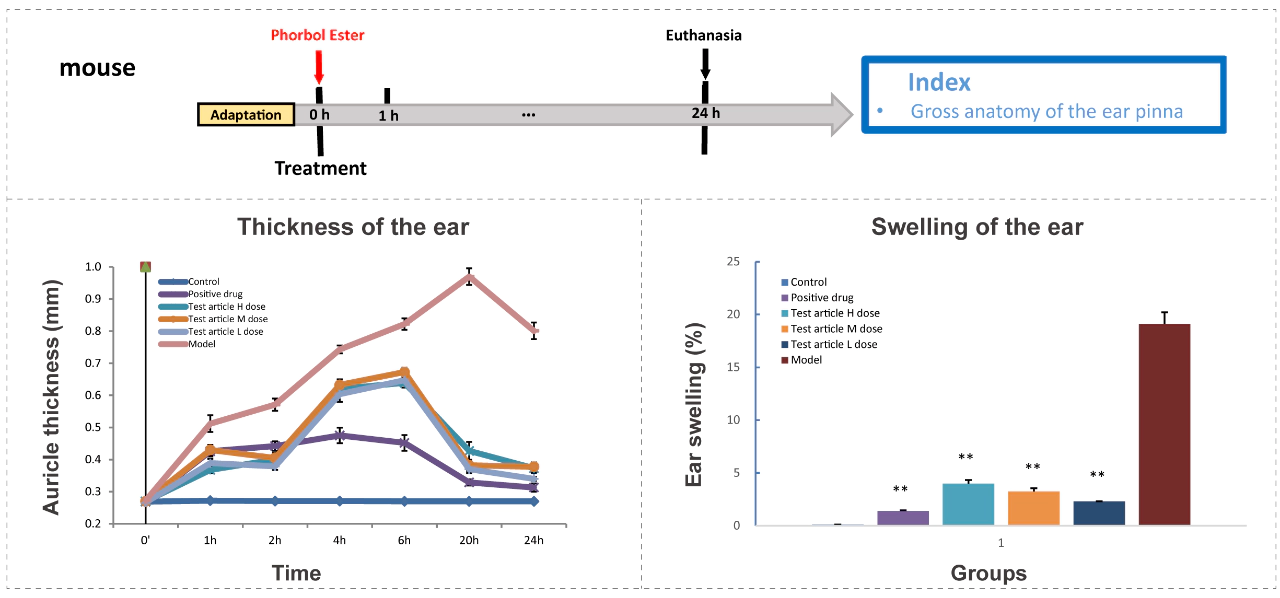
案例:伏波酯诱导的特应性皮炎
案例:化合物48/80诱导的小鼠急性瘙痒
❖ 实验动物:ICR小鼠,雄性
❖ 给药方式:涂抹给药
❖给药周期:单次给药
❖ 实验方法:除空白对照组小鼠皮下注射生理盐水外,其余组小鼠颈部中央皮下注射化合物48/80诱导瘙痒模型。
❖ 考察指标:30min内瘙痒行为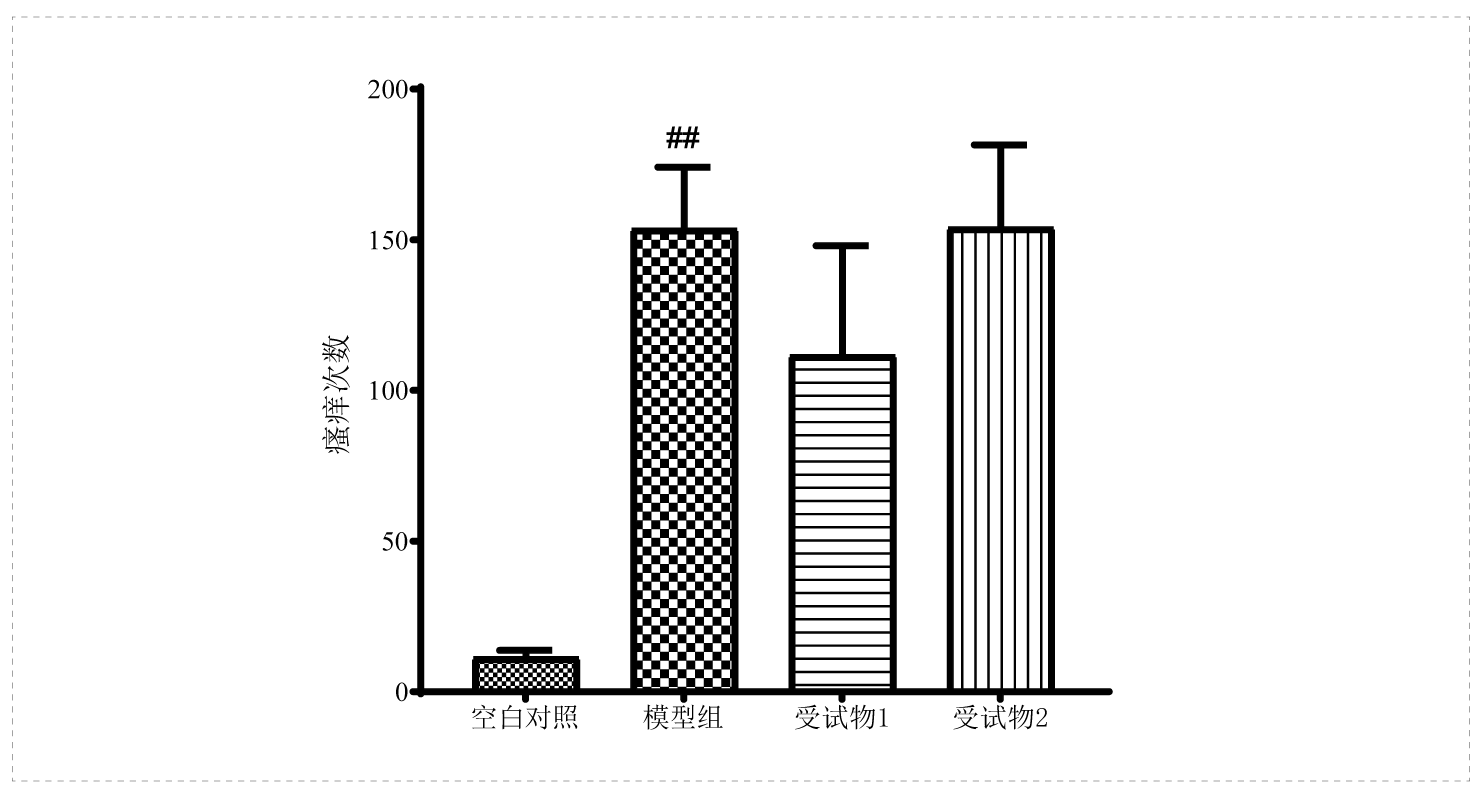
案例:糖尿病足药效学模型
❖ 实验动物:db/db小鼠
❖ 实验分组:对照组,模型组,阳性药硫辛酸组,阳性药七叶皂苷组
❖ 实验方法:小鼠适应性饲养后,异氟烷麻醉保留自主呼吸,俯卧位固定,待角膜反射消失后,手术剪在左后肢背部剪除全层皮肤,深达筋膜层,形成直径约6mm的圆形切割伤创面,造成皮肤溃疡模型。
❖ 考察指标:痛阈(机械痛,热痛),伤口愈合,足容积。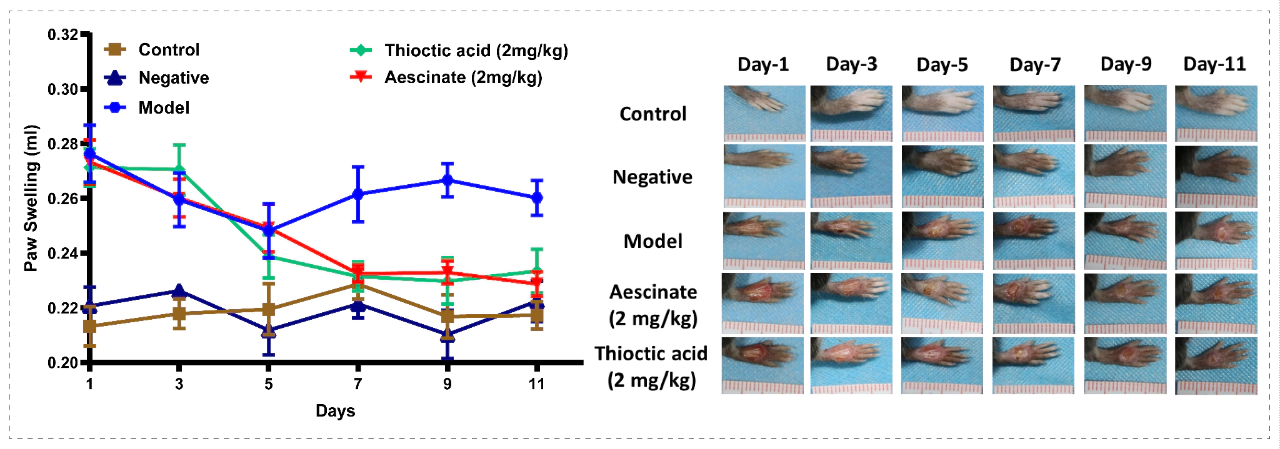 糖尿病足药效学模型—足容积
糖尿病足药效学模型—足容积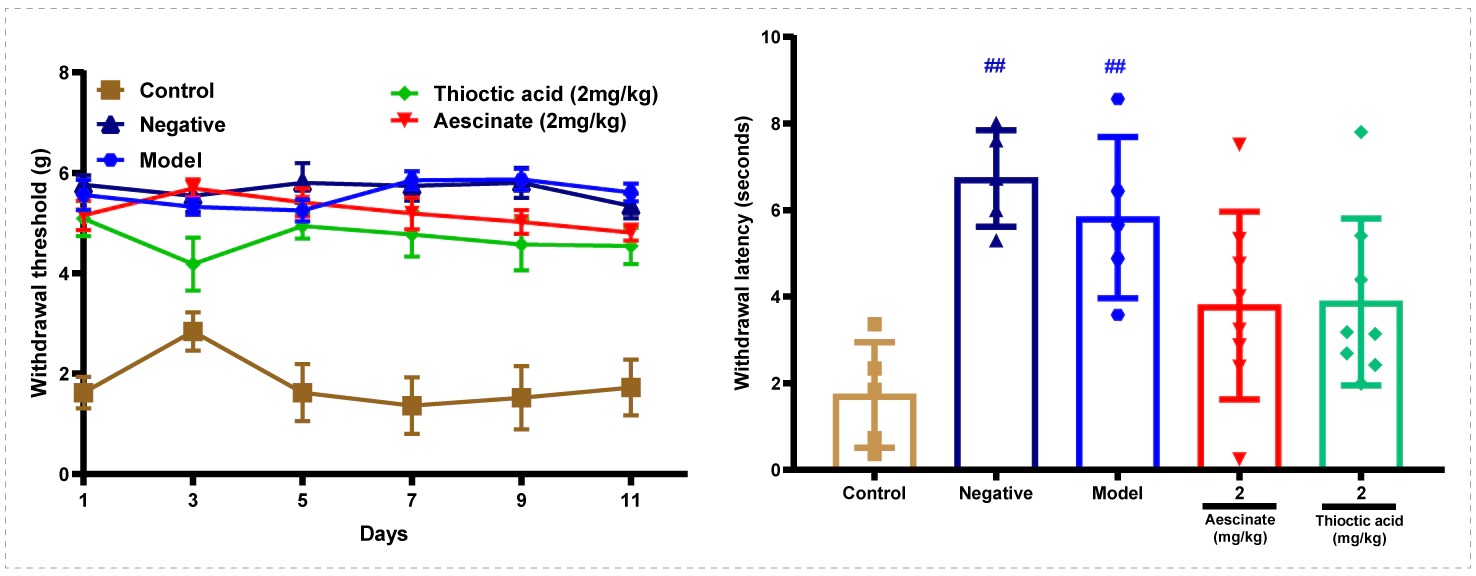 糖尿病足药效学模型—疼痛丧失
糖尿病足药效学模型—疼痛丧失- ❖ 受试物:应选用可代表临床样品的中试及以上规模、含辅料的制剂,优先选择临床拟用最大浓度/规格的浓缩剂型。❖ 参比制剂(仿制药):参考《特定药物的生物等效性指导原则》及橙皮书目录等,选择相应品种明确参比制剂。❖ 动物种属选择: 优先选择皮肤结构及生理与人类接近、背景数据较丰富的物种,以全面评估系统吸收和局部安全性。❖ 给药途径
啮齿类:多采用系统暴露方式;
小型猪:应模拟临床用药方式;❖ 皮肤状态:给药区域常位于肩胛至髋骨间体侧。需谨慎剃毛避免损伤。若临床用于破损皮肤,应依实际破损特征设计相应动物模型,如:砂纸打磨;针头划伤;化学腐蚀、激光、刀片等方式。❖ 给药剂量:应参考ICH M3,达到人体暴露量的数倍:低剂量应无或仅轻微毒性,高剂量应出现一定系统毒性(可伴轻微局部毒性),并设赋形剂对照。关键参数包括:低剂量;高剂量;给药面积;给药体积等。❖ 给药频率和周期:通常每日1次,也可根据临床方案调整;可连续或间歇暴露(如4–6小时),急性毒性试验常持续24小时;周期参照ICH M3(R2)。❖ 检测指标局部反应:包括刺激评分、被毛变化等;
解剖与组织病理:重点观察给药部位皮肤(如毛囊、腺体)及远位皮肤;常取样腹股沟区皮肤;
常规指标:临床表现、体重、心电图、眼科、血生化、尿常规等与其他药物类型要求一致。 1类新药
❖ 药理学研究
❖ PK/TK研究
❖ 一般毒性研究
❖ 遗传毒性研究
❖ 其他研究(局部刺激性、 过敏性、免疫毒性、光毒 性、致癌性、溶血等)PK/TK研究方案
❖ 局部吸收产生全身疗效(体内有暴露)
1. 体内药代试验:
1)体内药动学预试验——大鼠皮肤,mini猪皮肤;
2)体内药动学正式试验——大鼠和mini猪;
3)组织分布——大鼠;
4)排泄和代谢——大鼠
2. 体外药代实验:
1)血浆蛋白结合试验;
2)肝微粒/肝细胞代谢稳定性;
3)体内外代谢产物鉴定;
4)肝药物抑制;
5)诱导及代谢酶的表型;
6)药物全血/血浆分配比❖ 产生局部疗效(体内无暴露)
1. 体内药动学预试验——大鼠皮肤,mini猪皮肤(临床给药方式最大给药量)
2. 需对靶部位皮肤中药物的暴露量进行研究,考察评估皮肤外用引入的风险毒理试验
❖ 局部给药产生全身疗效(有系统暴露)
1. 安全药理学试验——呼吸/心血管/神经/
2. 剂量范围确定试验——大鼠+mini猪皮肤涂抹
3. 单次给药毒性试验——大鼠和mini猪
4. 重复给药毒性试验——大鼠和mini猪
5. 局部毒性试验——家兔皮肤刺激+角膜刺激,豚鼠皮肤过敏,光毒性试验
6. 遗传毒性试验——Ames/染色体畸变/微核❖ 毒理试验:局部给药产生局部疗效(无系统暴露)
1. 剂量范围确定试验——大鼠系统暴露+mini猪皮肤涂抹
2. 单次给药毒性试验——大鼠和mini猪
3. 重复给药毒性试验——大鼠和mini猪
4. 局部毒性试验——家兔皮肤刺激+角膜刺激,豚鼠皮肤过敏,光毒性试验- 美迪西外用制剂研发服务平台以科学严谨的研发体系、先进完备的设备平台、丰富多样的模型体系、合规高效的申报经验,为客户提供兼具深度与广度的外用制剂解决方案,是国内外药企在外用制剂领域值得信赖的合作伙伴。❖ 一站式服务:从API特性分析到申报资料提交,无缝衔接
❖ 灵活合作模式:可按模块提供服务(如药效、毒理、制剂等),也可全程委托
❖ 专家团队支持:拥有多年外用药研发经验的药效、毒理、制剂、分析专家
❖ 快速响应机制:项目周期短,数据质量高,助力客户加速上市参考文献:[1] Journal of The Minerals, Metals & Materials Society 64(4):449-468. DOI:10.1007/s11837-012-0302-8.
 外用制剂非临床研究考虑要点
外用制剂非临床研究考虑要点
 外用制剂非临床研究试验设计
外用制剂非临床研究试验设计
 总结
总结
 美迪西部分外用制剂研发服务案例:
美迪西部分外用制剂研发服务案例:
 化学药品1类创新药CKBA乳膏
化学药品1类创新药CKBA乳膏
CKBA 乳膏以中药乳香活性成分为先导化合物,经结构修饰优化而成,作用机制明确、安全性良好。作为泰恩康的长期合作伙伴,美迪西为CKBA乳膏提供了小型猪药代动力学研究、制剂安全性评价、体内光毒性试验等研究服务。
查看详情 新型外用小分子Wnt调节剂ELU42
新型外用小分子Wnt调节剂ELU42
ELU42在促进糖尿病足溃疡与三度烧伤愈合、减少疤痕形成方面展现出显著潜力。作为Eluciderm的合作伙伴,美迪西为ELU42的快速获批提供了毒理学研究服务,并荣获 Eluciderm 颁发的“卓越服务奖”。
查看详情 RA1115-B1滴眼剂
RA1115-B1滴眼剂
RA1115-B1滴眼剂主要用于治疗新生血管性(湿性)年龄相关性黄斑变性(wAMD),作为“锐明新药“的研发合作伙伴,美迪西为RA1115-B1滴眼剂的研发提供了原料药生产、原料药工艺开发、制剂处方工艺开发等服务。
查看详情