



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




人类基因组中最大的蛋白酶基因群被称为组织激肽酶(KLKs),其编码了一个由15个紧密相连的丝氨酸蛋白酶组成的家族。KLKs是蛋白酶激活受体信号传导的调节器,一些激肽释放酶能够催化其他激肽释放酶的激活,因此蛋白酶的级联反应涉及到稳态功能的调节。除了生理作用外,KLKs的异常表达和活性还与许多病理疾病有关,包括皮肤病、神经紊乱和癌症。在此情况下,KLKs作为生物标记被广泛研究。除了作为临床标记的用处外,KLKs现在被认为直接参与了多种癌症特征的形成,如化学抗性、细胞生长、侵袭、迁移和肿瘤微环境的调节。
KLK6是一种分泌丝氨酸蛋白酶,能够降解多种细胞外基质蛋白,属于组织激肽酶 (KLKs)家族。尽管KLK6是中枢神经系统中最丰富的蛋白酶之一,但我们对其知之甚少。
上世纪90年代中期,4个不同的群体均分离出KLK6,人类基因组测序完成后,KLK6被正确的归类为kallikrein家族的一员。在此后的研究中发现:
(1)、KLK6是乳腺癌和卵巢癌预后的一个重要的生物标志物,在中枢神经系统和脑脊液中大量表达。
(2)、与多发性硬化病变中活跃的炎性脱髓鞘区域密切相关。KLK6在多种神经退行性疾病如多发性硬化症、阿尔茨海默病和帕金森氏病中均有异常表达[1]。在使用KLK6抗体对多发性硬化小鼠模型进行自动免疫的研究显示,该疾病的发作明显延迟,严重性降低。
(3)、恶性黑素瘤微环境中的角质形成细胞(而非原发性肿瘤细胞)产生大量KLK6,然后通过激活蛋白酶激活受体1 (PAR1)促进肿瘤迁移和侵袭。
(4)、在卵巢癌中,KLK6的过表达与生存率呈负相关,也被认为在肿瘤侵袭性中发挥作用。
(5)、在胃癌[2]和胶质母细胞瘤[3]中,KLK6已被证明有助于治疗耐药性。
(6)、在头颈部癌症中,KLK6被发现可以促进细胞增殖和上皮间充质转化(EMT)[4]。
虽然KLK6抑制剂的研究领域相对不发达,但最近的研究方向凸显了人们的兴趣和需要进一步研究的必要性。
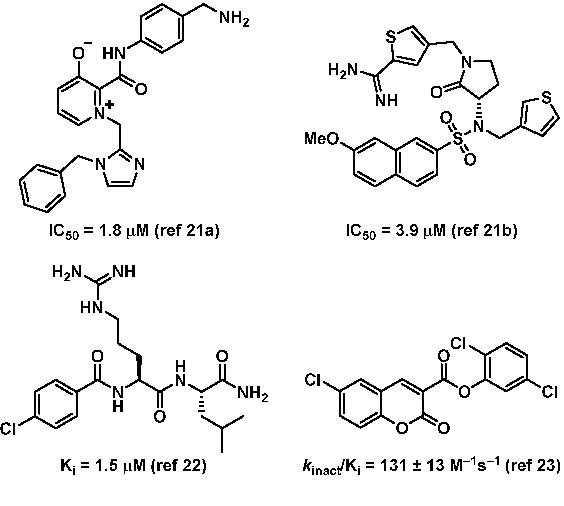
据我们所知,目前已有4种小分子KLK6抑制剂存在,但由于报告中没有针对相关蛋白酶活性的数据,所以这些化合物的选择性目前还不清楚。
KLK6和其他大多数KLK一样,具有类似胰蛋白酶的活性,由S1口袋中的酸性Asp189(胰蛋白酶编号)控制,它决定了KLK6底物P1中碱性精氨酸或赖氨酸残基的偏好。KLK6还含有Ser190,这是一种很难用中性P1抑制剂作为靶点的特性。通常,含有ser190的蛋白酶抑制剂需要P1中存在强碱性残基进行结合,但由于分子固有的带电状态,这可能会导致不好的药理性质。另外,由于Asp189和Ser190具有的高度保守的性质,使得其抑制剂的开发已被公认为具有较高的难度。而由于对选择性KLK6抑制剂的迫切需求,我们开始进行对现有困难的挑战,并发现了KLK6的有效和有选择性抑制剂。
开发抑制剂的一种常见方法是利用天然肽抑制剂作为起始点,利用组合或设计的突变,以有选择地向靶向KLK6转移。然而,亚型选择性KLK6抑制剂的开发仍然具有挑战性。
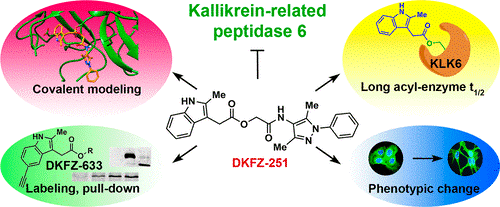
尽管不断有报道称KLK6在不同的病理中扮演着重要的角色,但它影响癌症和神经退行性疾病的分子机制尚不完全清楚。而缺乏选择性和有效性的抑制剂已经减缓了这类研究的进展,使其局限于蛋白沉默和过表达。在文献[5]中报道了第一类适合于研究KLK6生物学的抑制剂。该化合物是通过高通量筛选发现的,在组织kallikrein家族以及相关蛋白酶中具有很强的选择性和强效性,并能够短暂的酰化KLK6的抑制剂。
在silico模拟的辅助下,结构活性关系研究更加细致的揭示了对效力、稳定性和酰基酶复合物半衰期的严格要求。经过优化的小分子抑制剂DKFZ-251对KLK6的选择性较其他KLKs好,并且在细胞试验中有靶向活性。而DKFZ-633是一种基于抑制源的活性探针,可用于抑制内源性KLK6。
有效的抑制剂需要在快速反应和长期抑制之间取得适当的平衡。而对KLK6抑制剂的迫切需求推动着我们对其的深入研究,也期望能够找到更多有效并有选择性的KLK6抑制剂。
参考文献:
1, Patra, K. Soosaipillai, A. Sando, S. B. Lauridsen, C. Berge, G. Moller, I. Grontvedt,
G.R. Brathen, G. Begcevic, I. Moussaud, S. Minthon, L. Hansson, O. Diamandis, E.P. White, L. R. Nielsen, H. M. Assessment of kallikrein 6 as a cross-sectional and longitudinal biomarker for Alzheimer's disease. Alzheimer's Res. Ther.2018, 10, 1–11.
2, Kim, T. W. Lee, S. J. Kim, J. T. Kim, S. J. Min, J. K. Bae, K. H. Jung, H. Kim, B. Y. Lim, J. S. Yang, Y. Yoon, D.Y. Choe, Y. K. Lee, H. G. Kallikrein-related peptidase 6 induces chemotherapeutic resistance by attenuating auranofin-induced cell death through activation of autophagy in gastric cancer. Oncotarget 2016, 7, 85332–85348.
3, Drucker, K. L. Paulsen, A. R. Giannini, C. Decker, P. A. Blaber, S. I. Blaber, M. Uhm, J. H. O'Neill, B. P. Jenkins, R. B. Scarisbrick, I. A. Clinical significance and novel mechanism of action of kallikrein 6 in glioblastoma. Neuro-Oncology (Cary, NC, U. S.) 2013, 15, 305–318.
4, Schrader, C. H. Kolb, M. Zaoui, K. Flechtenmacher, C. Grabe, N. Weber, K. J. Hielscher, T. Plinkert, P. K. Hess, J. Kallikrein-related peptidase 6 regulates epithelial-to¬mesenchymal transition and serves as prognostic biomarker for head and neck squamous cell carcinoma patients. Mol. Cancer 2015, 14, 1–14.
5, Elena De Vita, Peter Schüler, Scott Lovell, Jasmin Lohbeck, Sven Kullmann, Eitan Rabinovich, Amiram Sananes, Bernd Heßling, Veronique Hamon, Niv Papo, Jochen Hess, Edward W. Tate, Nikolas Gunkel, and Aubry K. Miller. Depsipeptides Featuring a Neutral P1 Are Potent Inhibitors of Kallikrein-Related Peptidase 6 with On-Target Cellular Activity.J. Med. Chem., 2018, 61 (19), pp 8859–8874.
 相关新闻
相关新闻