全球新冠疫情风波未平,今年5月在欧洲率先爆发的猴痘疫情再次引发狂澜,7月23日,世界卫生组织WTO宣布将猴痘列为国际突发公共卫生事件。
尽管我国目前尚未发现猴痘的相关病例,但全球感染病例数已超4万,累计有92个国家或地区发现确诊,让人们不得不担忧猴痘是否会步新冠病毒的后尘,成为下一个全球大流行病。
图源中国科学院上海巴斯德研究所[1]
对此,我国专家在8月7日于上海召开的猴痘病毒研究及防控应对论坛上持乐观态度。我国虽然存在输入性病例的风险,但由于猴痘病毒不像新冠病毒那样通过呼吸道传播,而主要通过血液和体液传播,因此它在普通人群中的基本传染数小于1,民众无需过多恐慌。
猴痘病毒是一种包膜双链DNA病毒,呈长方形,属痘病毒科的正痘病毒属,而猴痘是一种与天花类似的病毒性人畜共患病,主要症状为发热、剧烈头疼、淋巴结肿大、肌肉酸痛和集中在面部、手掌脚底、口腔黏膜的皮疹。猴痘并不是新病毒,其早在1958年就被发现并命名,本次全球范围内大规模传播的很大原因是自1980年宣布消灭天花病毒并停止接种天花疫苗,大部分人对于和天花同属一个病毒家族的猴痘病毒没有免疫力。
为此,在WTO宣布猴痘疫情已构成“国际关注的突发公共卫生事件”的第二天,欧盟委员会就紧急批准了巴伐利亚北欧公司的保护成年人感染天花的Imvanex疫苗用以预防猴痘,这也是目前唯一一款被批准用以预防猴痘的疫苗。根据非洲的以往试验数据表明,天花疫苗在预防猴痘方面有至少85%的效果,天花疫苗可以在很大程度上保护人们免于感染猴痘。
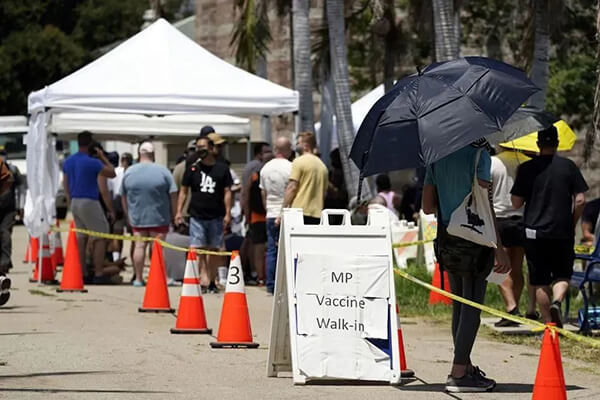
美国旧金山数百人排队接种猴痘疫苗[2]
但从目前全球天花疫苗的储备和生产能力看,供给还远远满足不了需求。在猴痘疫情最为严重的英国和美国,甚至出现了排了几小时的队都打不上疫苗的情况。介于这种情况,加之目前尚无批准用于猴痘治疗的特定治疗方法,或许可考虑使用抗DNA病毒的小分子药物及免疫球蛋白疗法。美国CDC推荐天花疫苗用于猴痘的暴露后预防,同时也推荐结合现有的西多福韦、Brincidofovir、特考韦瑞、痘苗免疫球蛋白等药物进行疫情控制。
突如其来的猴痘病毒给全球医疗系统带来了极大的压力,事急从权,才出现了天花疫苗被批准适用于猴痘预防的应急措施。一般来说,新适应症的正常增加需要进行新的药学研究和申报。

由于药品只是新增适应症,在分子、结构、API和制剂上没有变化,因此相关的药学研究试验可以省略,新适应症申报材料上也不用再次提交。而药效试验是进行新适应症研究中的必做的关键,针对新适应症使用对应的体外模型或动物模型进行药效试验,得到有效的临床前数据,证明该药物在动物身上针对新适应症具有有效性,能充分支持临床申报的顺利进行。
关于已上市药品新增适应症,除了可以省略的药学研究和必须重做的药效试验外,根据不同的情况,安评和药代的试验有不同的需求:
○ 该新适应症已在国外获批:因不存在安全性问题,申报临床只需提供药效学试验证明在动物中的有效性即可。但鉴于国外尚未进行人种差异的临床试验,申报上市时必须提供在中国人中的临床研究,以验证新的适应症在中国人中的有效性和安全性;
○ 新适应症在国内外均未获批:临床研究按照创新药的要求;
需延长用药周期/增加剂量:由于用药窗口期发生改变,可能存在新的安全问题,因此必须重做药代试验和安评试验,特别是有关急毒和长毒的毒理研究;
○ 若新适应症拟定的剂量未超过原单次用药最大剂量:先进行剂量探索试验,筛选出有效剂量,再扩大试验验证药效和安全性;
○ 若新适应症拟定的剂量超过原单次用药最大剂量:先进行耐受性试验,确认剂量的安全范围,在该范围中进行剂量探索试验,筛选出有效剂量,再扩大试验验证药效和安全性;
○ 改变剂型/给药途径后根据前体药机制申请适应症:需要重新考察改变剂型后的ADME药代动力学情况,还有生物利用度情况也是申报的重要依据;
○ 据药物原先临床前研究时间较久导致官方审评要求已变:根据官方最新要求和指标补充重做一些安评和药代试验;
……
正常情况下,安评和药代否需要重做,则需要根据本次药品新适应症的情况咨询专家和CDE后才能下结论。

美迪西注册团队深入了解中国和美国法规政策环境以及药物的技术要求,能为客户提供NMPA的
IND申报,US FDA的IND/ANDA申报服务,同时可为客户定制切实可行的注册策略,规避潜在的注册风险,确保及时准确地递交申报材料,跟踪、推进审评进度,协助客户项目顺利拿到批件。
参考资料:
[1]http://www.shanghaipasteur.cas.cn/xwdt2016/zhxw2016/202208/t20220808_6497490.html
[2]https://abc7news.com/monkeypox-vaccine-clinic-zuckerberg-san-francisco-general-hospital-doses/12091129/
[3]http://finance.sina.com.cn/jjxw/2022-08-08/doc-imizmscv5311679.shtml
[4] 张杰. (2004). 对申请增加新适应症的思考与医学一般性的技术要求.













 相关新闻
相关新闻