



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




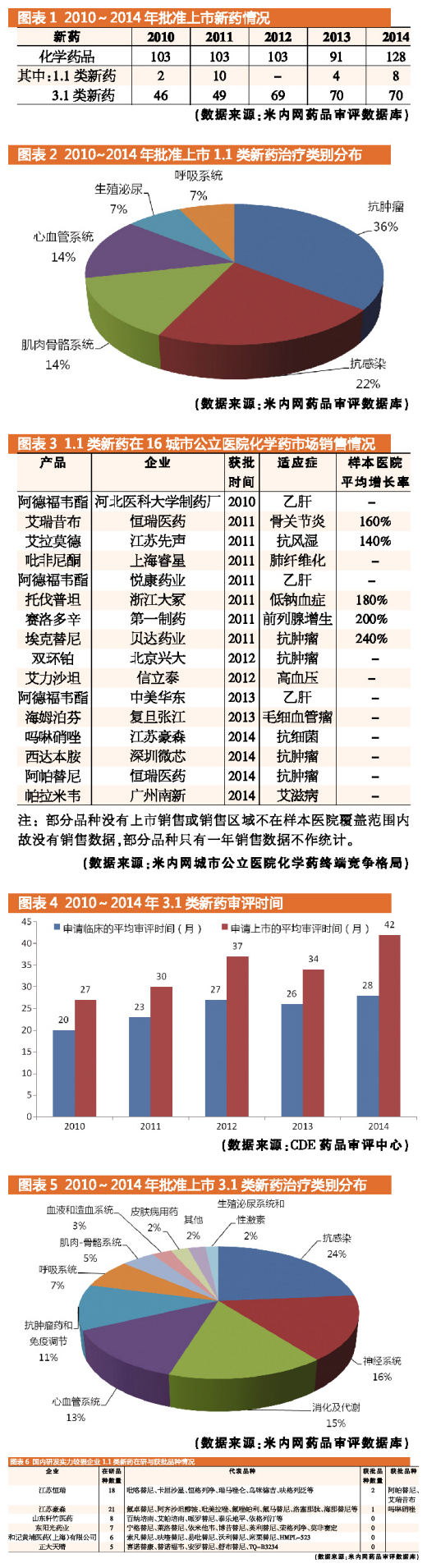
目前化学药是中国制药企业的主要研发领域。根据CDE数据,化学药的申请受理量以每年7.5%的速度逐年增加。CDE面临的审批任务日见加重,药企间的审批竞争也越来越激烈。
从2010~2014年国内获批上市的新药来看,平均每年均有100个左右的化学药新药获批上市。2014年,CDE加快了新药审评速度,批准上市新药的数量与往年相比有所增加,但药品审评积压的情况仍然严重,仅2014年积压的药品待审任务就多达18597件。
癌症、心血管是重点领域
国内1.1类药物的开发还处于起步阶段。目前国内1.1类研发实力较强的企业有江苏恒瑞、江苏豪森、和记黄埔医药(上海)有限公司、东阳光药业、正大天晴等企业,上述企业产品池内都有5个以上的在研或已获批的1.1类新药。其中,癌症、心脑血管等大病领域以及单抗药物仍然是企业研发投入的重点领域。
1.1类新药的开发具有风险大、周期长的特点。从2010~2014年1.1类新药审批情况可以看出,1.1类新药的产生主要集中在抗肿瘤与抗感染两大领域。其中,抗肿瘤药的研究重点是小分子靶向药物,抗感染药的研究重点则为抗病毒治疗药物。此外,随着我国人口老龄化加剧,肌肉骨骼系统疾病、心血管系统疾病也是研究的热点。
从申请临床到获批上市平均花费7.6年
从审评时间看,1.1类新药从申请临床到上市获批,最长的花了10年,最短的花了5年,平均花费7.6年。其中,申报临床的平均审评时间为14个月,总体趋于稳定;申报生产的平均审评时间为29个月,但到了2014年审评时间增加到了42个月,远超总体平均水平。
1.1类并非畅销药保证
1.1类新药研发周期长,研发投入大,那么它们上市后的销售情况如何呢?我们通过米内网城市公立医院化学药终端竞争格局对上述1.1类品种的销售情况进行了监控。(见图表3)
从监控到的数据看,1.1类新药并不能成为药品畅销的保证,其中阿德福韦酯不能算原创新药,该药市场由原研厂家中美史克及正大天晴、天津药物研究院、福建广生堂等强势国产仿制药企业占据,3个获得1.1类新药批文的企业只占少量的市场份额。海姆泊芬、吡非尼酮因适应症小而市场有限。近年来销售最好、规模过亿元的1.1类品种只有贝达药业的靶向抗肿瘤药埃克替尼。此外,江苏先声的艾拉莫德、恒瑞医药的艾瑞昔布、浙江大冢的托伐普坦也有不错的销售成绩,但与畅销品种相比仍有很大距离。
对于1.1类新药,国内企业目前普遍模式并不是原创新药,某种程度上仍是低水平的Me-too开发,即通过对已验证靶点有活性的化合物进行结构修饰而获得专利,因此存在一定的市场滞后性而不能给企业带来确定的回报。不过,鉴于2010年以后上市的品种都没有进入医保目录,而进入医保目录对药品销售的提升有很大的促进作用,期待即将到来的医保目录调整能为这些1.1类新药带来惊喜。
3.1类集中于五大类别
3.1类新药品种较多,主要集中在抗感染、神经系统、消化及代谢、心血管系统抗肿瘤与免疫调节五个大类。统计发现,3.1类新药申报临床的平均审评时间为27个月,申报上市的平均审评时间为34个月,且审批时间逐年持续增加,与1.1类新药的审评时间基本相当。截止2014年,3.1类新药从申报临床和获批上市的平均时间接近6年(70个月),可见3.1类新药的申报耗时亦十分漫长。
与1.1类新药相比,国内3类新药的开发已日趋成熟,并为企业带来可观的利润。由于3类新药开发风险和成本较1.1类新药小,3.1类新药开发申报竞争激烈。3类新药是仿制药,有4年新药监测期,未到期前CDE不再受理进口和国产的注册申请,因此,3类新药兼顾“首仿”和“新药”头衔。
美迪西CMC专家拥有数十年的工作经验,熟悉各种ICH和CFDA的法规和指导规则,帮助很多客户顺利完成了他们的药物制剂前和药物制剂研究,为申报资料提供了可靠的数据。其中,我们成功地协助很多客户完成了1.1类,3.1类和6类新药的CFDA申报