



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




天价困局,有望被一针注射破解。这就是体内CAR-T!
无需体外转染T细胞和做淋巴清零,,直接在患者体内激活T细胞追杀癌细胞。它正从“天价特效药”走向“普惠针剂”,但能否成功,取决于一项核心挑战——如何将CAR精准、高效、安全地递送到T细胞。递送系统如何成为决胜关键?以及如何将癌症乃至自身免疫病的治疗推向更简单、更可及的未来?
请听美迪西详解——
CAR(嵌合抗原受体)的主要结构通常由胞外抗原结合域、跨膜域和胞内信号域组成。
❖胞外抗原结合域:主要负责特异性识别并结合靶细胞表面的肿瘤抗原。通常由抗体的单链可变片段(scFv)构成,包含可变轻链(VL)和可变重链(VH),通过多肽连接形成。
❖跨膜域:将CAR锚定在细胞膜上,同时影响CAR的表达水平、稳定性和信号传导等。
❖胞内信号域:负责激活细胞内的信号通路,诱导细胞增殖、细胞因子分泌和细胞毒性等免疫功能。通常包含信号激活结构域(如CD3ζ)和一个或多个共刺激因子(如CD28、4-1BB等),共同传递激活信号,增强T细胞的免疫活性。
从第一代到第五代,CAR结构经历了逐步演变。
❖第一代CAR:结构为scFv-CD3ζ,仅包含抗原识别域(scFv)和T细胞激活信号域(CD3ζ)。第一代CAR能特异性识别肿瘤抗原并启动T细胞杀伤,但缺乏共刺激信号,导致T细胞在体内增殖能力弱、持久性差,抗肿瘤效果有限。
❖第二代CAR:在第一代基础上加入共刺激域(如CD28或4-1BB),形成scFv-CD3ζ-CD28/4-1BB结构。共刺激域显著增强了T细胞的增殖、存活和细胞毒性,使CAR-T细胞在体内能更持久地发挥作用。
❖第三代CAR:整合两个共刺激域(如CD28+4-1BB),理论上进一步提升T细胞的激活强度和持久性。但临床研究显示可能存在因过度激活导致的免疫副作用,临床优势并未显著优于第二代,因此目前主流仍是第二代(CD28或4-1BB)。
❖第四代CAR:也称为“重定向用于普遍细胞因子杀伤的T细胞”(TRUCKs)。为让CAR-T细胞更好地在肿瘤微环境中发挥功能,第四代CAR在第二代CAR的基础上通过引入可诱导的细胞因子表达框实现了CAR-T细胞识别肿瘤抗原后分泌具有治疗功能的生物活性分子的能力,如细胞因子IL-12、IL-15、IL-18等。这些分子具有促进T细胞增殖、增强T细胞持久性。有助于克服肿瘤微环境(TME)的免疫抑制作用,增强CAR-T细胞的杀伤活性。
❖第五代CAR:在第二代结构基础上,加入细胞因子受体结构域(如IL-2Rβ)和STAT招募基序,通过激活JAK-STAT信号通路,增强T细胞的自主激活和增殖能力,减少对外源IL-2的依赖,降低副作用。该代CAR目前处于临床研究阶段,旨在进一步提升疗效和安全性。
每一代CAR的设计都在前一代基础上优化,逐步解决了T细胞激活、持久性、安全性等问题,推动CAR-T细胞疗法从实验室走向临床应用,并不断拓展其在血液肿瘤、实体瘤及自身免疫疾病等领域的治疗潜力。
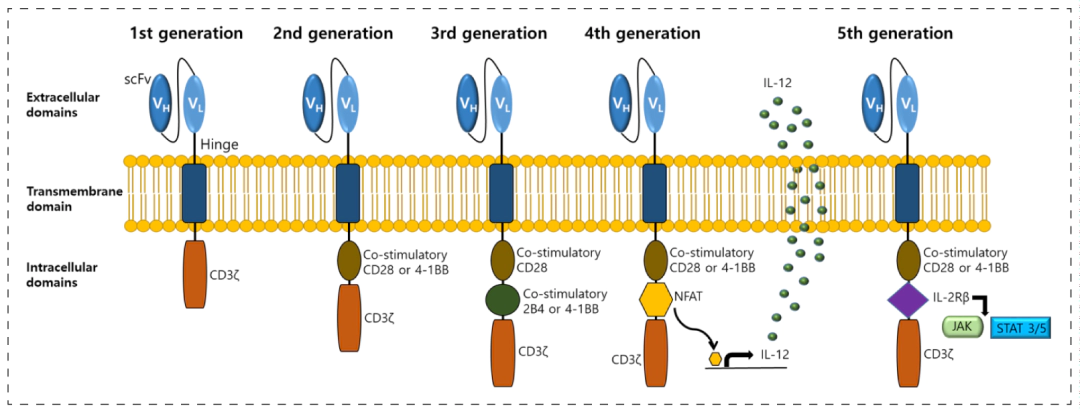
CAR构建体历经五代发展而来[1]
体外CAR-T细胞疗法是指通过外周血单采(leukapheresis)获取患者自身或健康供体来源的T细胞,随后利用编码特异性肿瘤相关抗原的CAR构建体对T细胞进行基因修饰。经体外培养与扩增后,将获得的CAR-T细胞回输至患者体内。回输后的CAR-T细胞可特异性识别并清除表达靶抗原的肿瘤细胞,并在体内形成持续的抗肿瘤免疫效应,从而有望降低肿瘤复发风险。
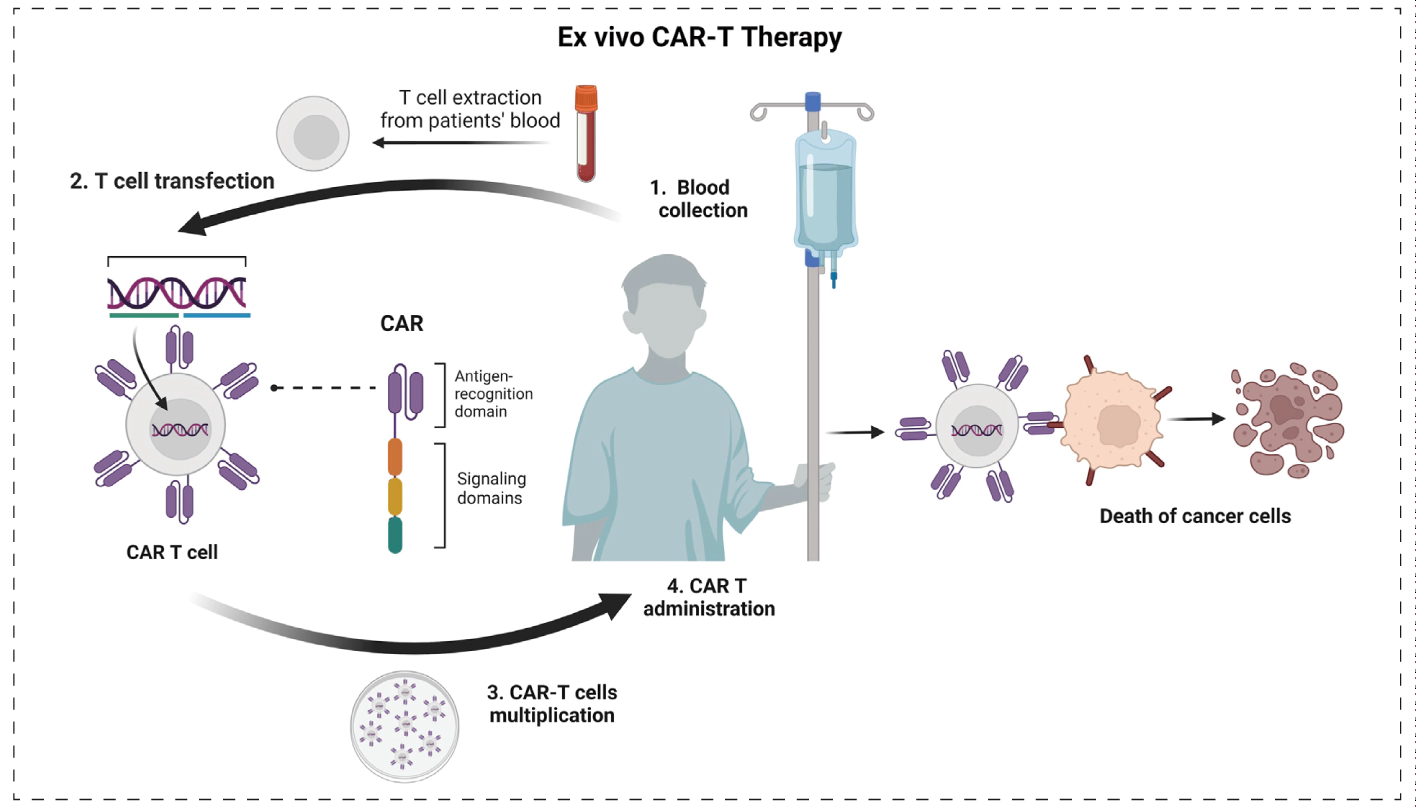
体外CAR-T细胞疗法的流程[2]
体内CAR-T细胞疗法通过体内递送方式绕开了传统体外CAR-T细胞制备流程。该策略将编码CAR的基因编辑构件封装于病毒载体或非病毒纳米递送系统中,经全身给药后实现对T细胞的体内靶向转导或转染,从而诱导CAR构件在内源性T细胞表面表达。生成的CAR-T细胞可在体内特异性识别表达靶抗原的肿瘤细胞,并在抗原刺激下被激活和扩增,进而介导抗肿瘤效应。
相较之下,体外CAR-T细胞疗法依赖于外周血单采、体外基因修饰与扩增等复杂的制造流程,不仅生产周期长、成本高昂,而且对起始T细胞数量和功能状态具有较高要求;同时,患者通常需接受淋巴清除性化疗以促进回输CAR-T细胞的体内扩增,从而增加治疗相关毒性风险。此外,体外扩增后的CAR-T细胞在回输后可能引发细胞因子释放综合征(CRS)及神经毒性等严重不良反应。
在理论上,体内CAR-T细胞疗法有望避免或减轻上述限制,包括简化制造流程、降低治疗成本、缩短治疗周转时间,并减少对淋巴清除性预处理和体外T细胞操作的依赖,从而为患者提供更具可及性和便利性的治疗选择。
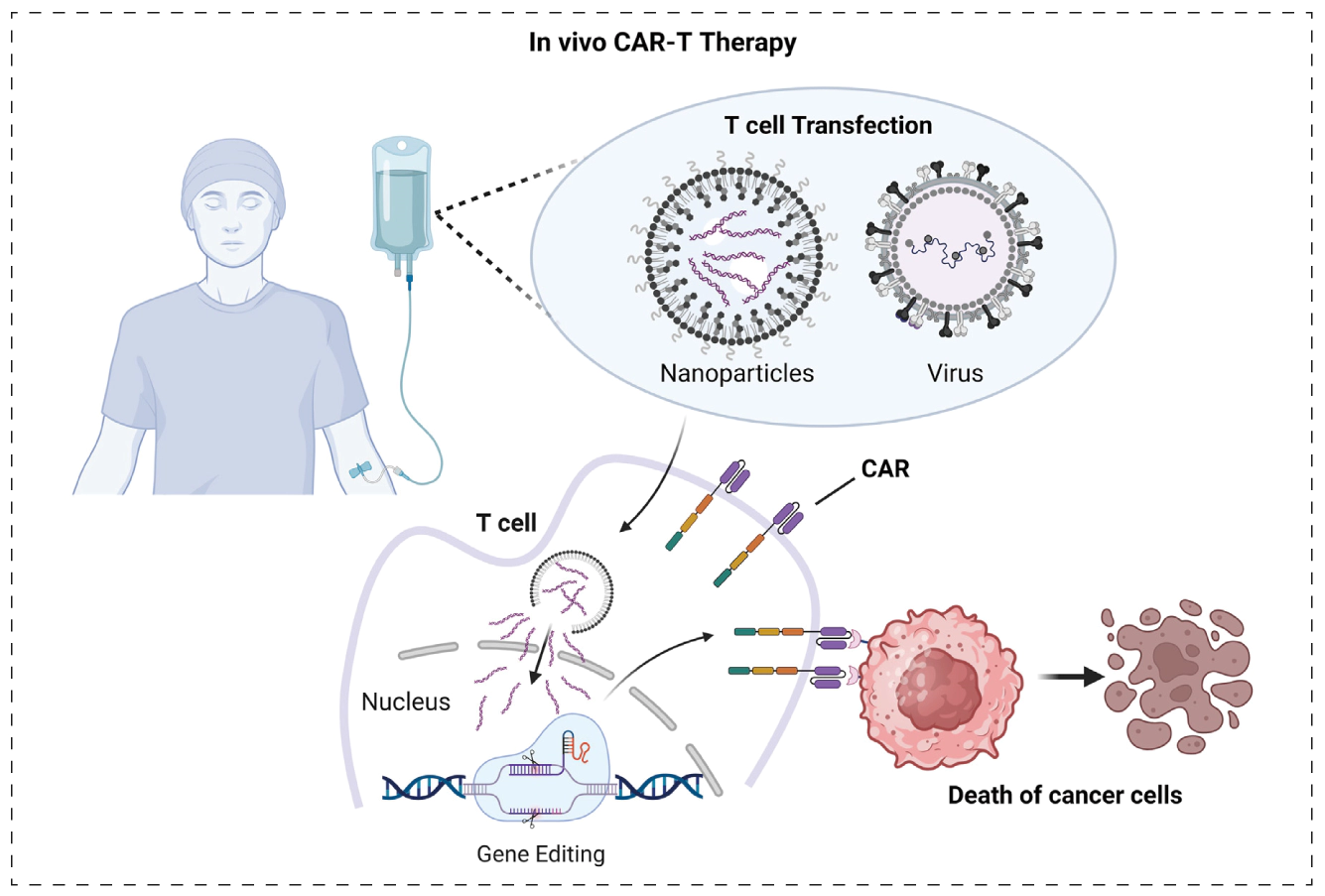
体内CAR-T细胞疗法治疗癌症的示意图[2]
体内CAR递送需要满足包括精确T细胞靶向、高基因编辑效率和低毒性等特定标准。目前,病毒载体和非病毒纳米载体被广泛研究并用于CAR构件的体内递送。
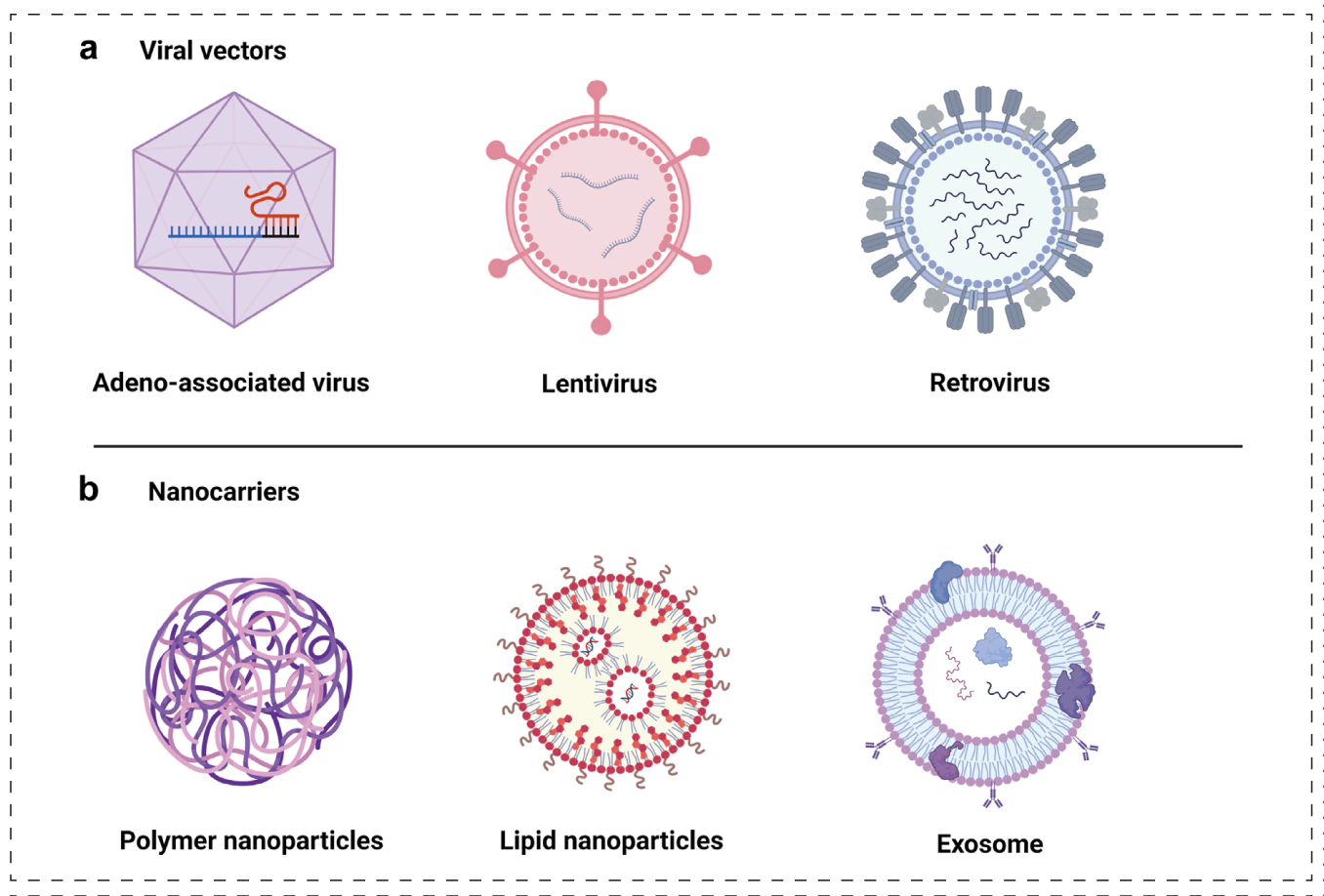
体内CAR-T细胞生成的递送载体[2]
❖病毒载体:腺相关病毒(AAV)、慢病毒和逆转录病毒;
对于体内CAR-T细胞生成,这些病毒载体可以通过加入T细胞靶向配体进一步工程化,以特异性靶向T细胞。这些配体可以通过基因融合到病毒包膜蛋白上,或通过化学偶联连接到病毒载体上。尽管在临床前阶段显示出有希望的结果,但病毒载体由于其潜在的基因组整合风险或脱靶转导,及触发免疫反应等而引起安全问题。
❖非病毒纳米载体:聚合物纳米载体、脂质纳米颗粒(LNP)和外泌体。
与病毒载体相比,纳米载体提供相对较低的脱靶毒性和免疫原性,并且可以大规模制造。此外,纳米载体(如LNP)可通过与不同的靶向生物材料偶联进行定制设计,以实现靶向能力。实现高效、特异靶向T细胞的核心挑战之一,在于设计和筛选具有特定靶向性、可电离性及膜融合能力的新型脂质分子。这类分子的设计与快速合成,是优化LNP递送平台、攻克体内T细胞转染难题的基础。
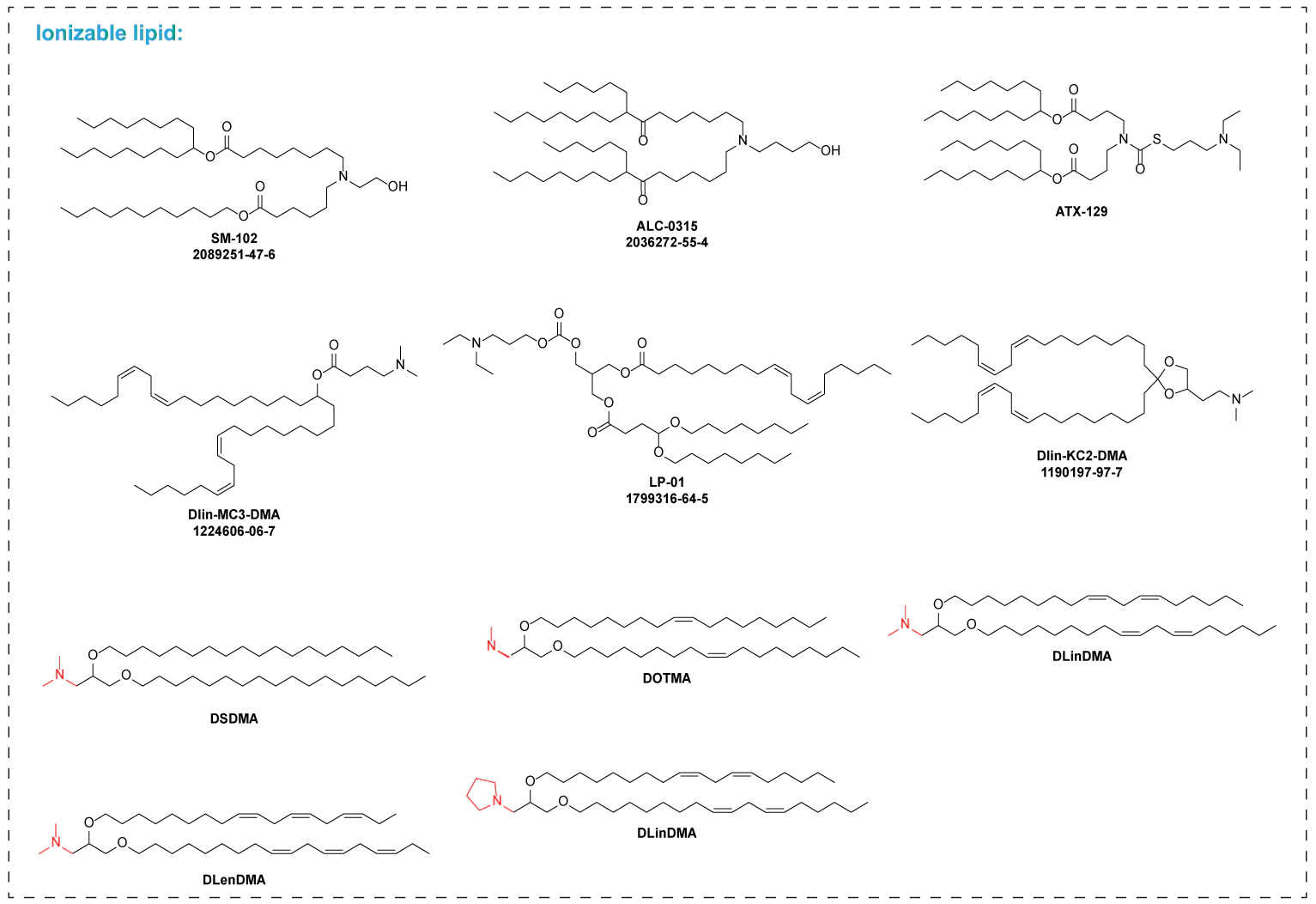
美迪西在此领域可提供专业的“LNP递送平台”服务,包含了此类关键脂质分子的设计、合成与筛选能力,从而能够支撑研究人员快速构建和优化靶向T细胞的LNP载体。
❖脂质分子库:拥有超过2000种可电离脂质的合成与筛选经验,可针对T细胞靶向进行定制化设计。
❖偶联工艺开发:提供小试到中试、公斤级放大的全流程开发与优化服务。
❖分析表征:涵盖粒径、包封率、抗体活性、靶向效率等多维度评价体系。
❖CMC支持:提供从早期研发到IND申报的化学、制造与控制(CMC)全流程支持。

目前有多种方式可实现抗体与LNP的偶联与制备,如一锅法、表面偶联法及后修饰法等。
❖一锅法:在LNP形成过程中直接加入配体-脂质偶联物。此法简单,但对配体的稳定性要求高,更适用于叶酸、甘露糖等物理化学性质稳定的小分子配体。
❖表面偶联:在预制LNP表面进行化学反应,连接配体。
❖后修饰法:将预制的LNP与含有配体-脂质偶联物的胶束混合,利用脂质插入原理将配体“锚定”到LNP表面。这种方法效率高,对配体损伤小。
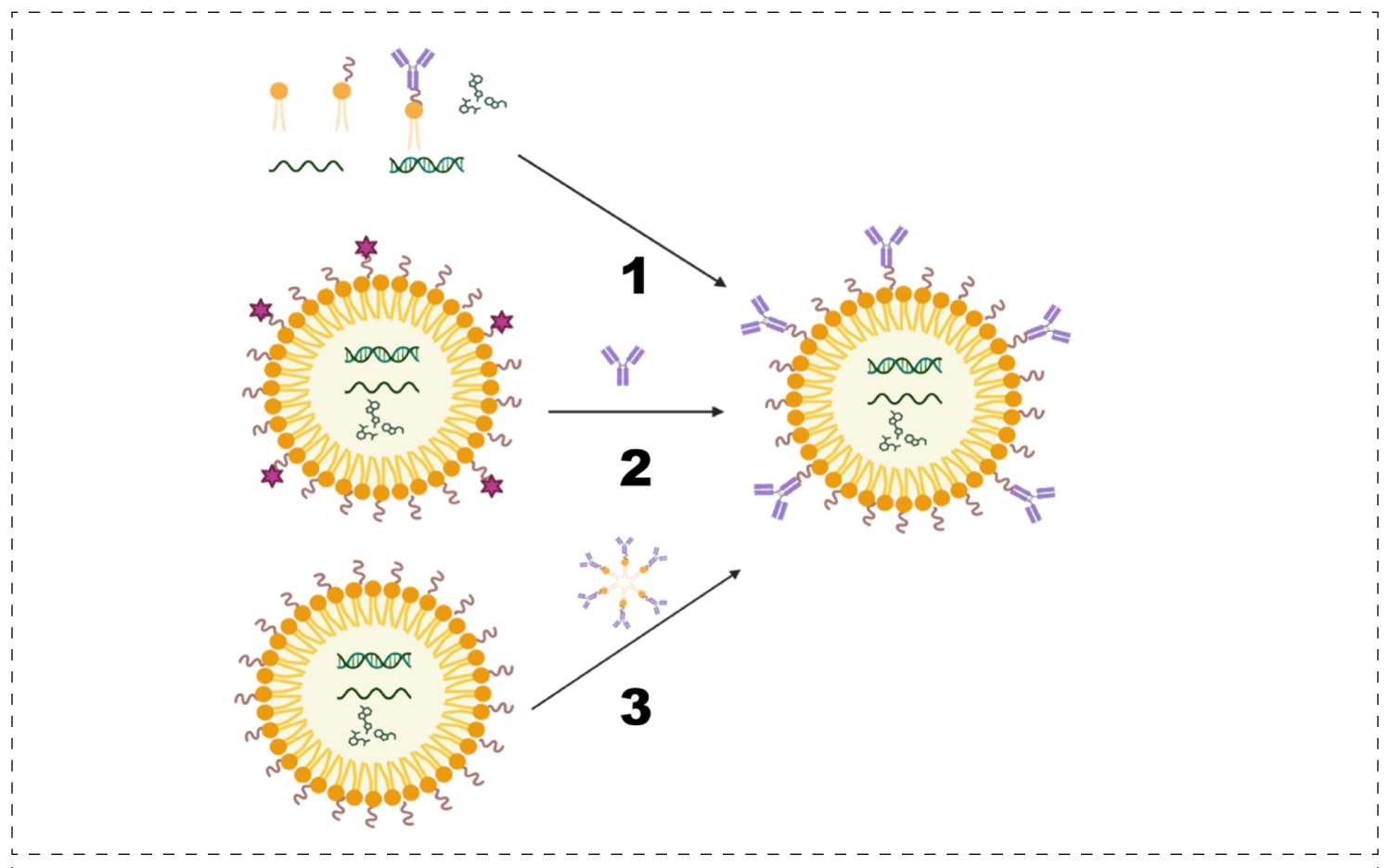
Ab-LNP的制备方法[3]
CAR-T细胞疗法在血液系统肿瘤中的成功,推动了其向非肿瘤适应症的拓展,尤其是在自身免疫性疾病领域的探索。与肿瘤治疗中追求CAR-T细胞长期体内持久性不同,体内CAR-T细胞疗法在自身免疫疾病中的设计目标通常是实现CAR的短期、可控表达。
通过体内递送编码CAR的基因构件,可在内源性T细胞中暂时诱导CAR表达,从而快速清除致病性B细胞群体(如CD19⁺ B细胞)。在完成靶细胞清除后,CAR表达随载体或转录活性衰减而消失,避免了长期存在的CAR-T细胞对正常免疫系统的持续干扰。随后,机体在数周至数月内经历B细胞再生与免疫系统重建过程,新生B细胞往往具有更健康的免疫耐受谱系,从而实现对自身免疫性疾病的功能性缓解。
该“快速清除—自然恢复—免疫重整”的治疗范式,使体内CAR-T细胞疗法在自身免疫性疾病中更接近于一种免疫重置(immune reset)策略,而非持续性细胞治疗,为降低长期免疫抑制风险和治疗相关毒性提供了新的可能。
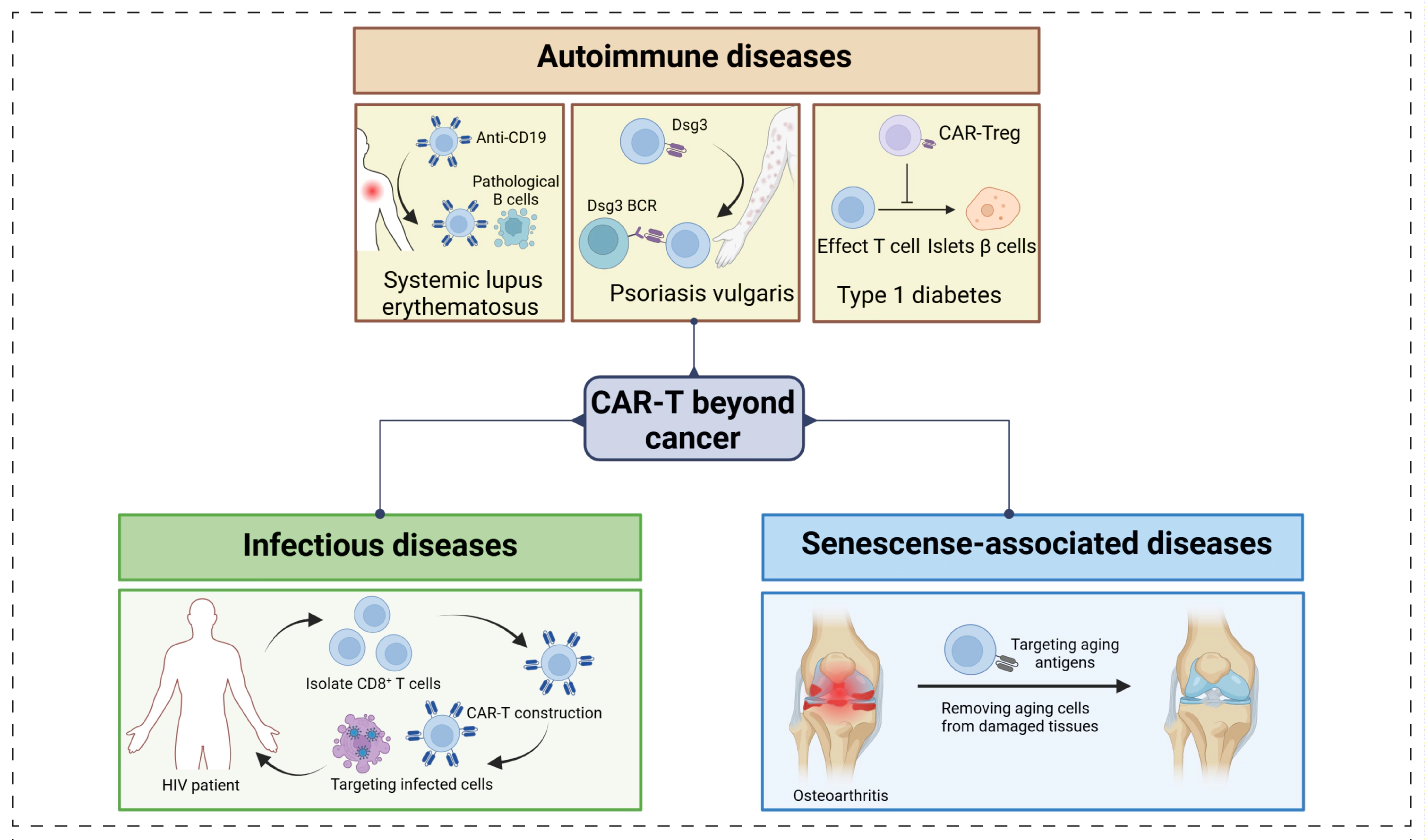
CAR-T细胞用于治疗非癌性疾病[4]
体内CAR-T细胞疗法并非简单地将体外CAR-T的制备流程“体内化”,而是在治疗范式上对细胞治疗的一次重构。其核心价值在于通过体内递送实现对内源性免疫细胞的可控工程化改造,从而降低对复杂体外操作和集中式制造体系的依赖。
在自身免疫性疾病等非肿瘤适应症中,体内CAR-T更可能以短期CAR表达、快速靶细胞清除与免疫系统重建为主要目标,发挥“免疫重置工具”的作用;而在肿瘤治疗领域,其发展路径则更依赖于递送效率、靶向特异性及安全性窗口的进一步拓展。不同适应症背景下,对CAR表达持续性、细胞扩增动力学及风险容忍度的要求将呈现显著差异。
尽管体内CAR-T仍面临精准递送、免疫相关毒性及长期安全性评估等关键挑战,但随着病毒与非病毒递送技术的持续演进,临床价值正在逐步被验证,并覆盖越来越多的适应症。未来,体内CAR-T更可能以适应症分层、风险可控、机制导向的方式融入治疗体系,造福人类健康。
参考文献:
[1] Min Hwa Shin, et al. Recent Advances in CAR-Based Solid Tumor Immunotherapy. Cells. 2023 Jun 11;12(12):1606. doi: 10.3390/cells12121606.
[2] Thuy Anh Bui, et al. Advancements and challenges in developing in vivo CAR T cell therapies for cancer treatment. EBioMedicine. 2024 Aug:106:105266. doi: 10.1016/j.ebiom.2024.105266.
[3] Sheryl Wang, et al. Unleashing the Potential: Designing Antibody-Targeted Lipid Nanoparticles for Industrial Applications with CMC Considerations and Clinical Outlook. Mol Pharm. 2024 Jan 1;21(1):4-17. doi: 10.1021/acs.molpharmaceut.3c00735.
[4] Zishan Yang, et al. Expanding the horizon of CAR T cell therapy: from cancer treatment to autoimmune diseases and beyond. Front Immunol. 2025 Feb 19:16:1544532. doi: 10.3389/fimmu.2025.1544532.
 相关新闻
相关新闻