



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




小核酸药物行业发展迅速,至今已有23款药物获批,成为继小分子和抗体药物后的第三波创新药浪潮。然而受限于递送手段以及内体逃逸难题,目前已上市的小核酸药物的靶向范围主要集中在肝脏。小核酸抗体偶联药物(AOC)结合了小核酸药物的精准性和抗体等大分子药物的特异性两大优点。
AOC的意义:利用抗体药物的特异性作用,解决小核酸药物的靶向问题,使小核酸药物能特异性地递送至目标细胞内部,进而靶向并调控疾病相关的mRNA;最终促进小核酸药物安全、有效、选择性地治疗疾病等。
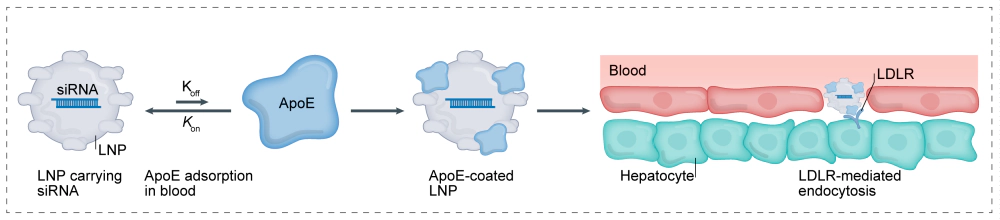
将小核酸药物包裹在脂质纳米颗粒(LNP)中,使被包裹的小核酸药物免于降解和清除,并促进其跨细胞膜运输到目标靶位。LNP通过肝细胞表面低密度脂蛋白受体识别和摄取,适用于治疗肝脏相关的疾病。
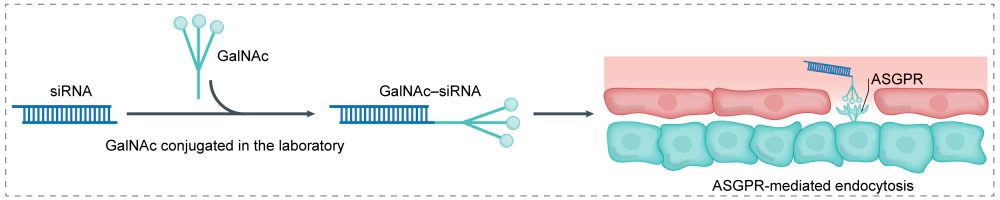
N-乙酰半乳糖胺(GalNAc)通过与寡核苷酸共价连接,其内吞递送依赖肝细胞ASGPR介导的受体循环。进入内体后的酸化环境促进受体–配体解离,从而释放寡核苷酸药物。ASGPR在内体酸化后快速回收至细胞表面,可反复参与配体结合,从而实现高效、可重复的肝摄取。
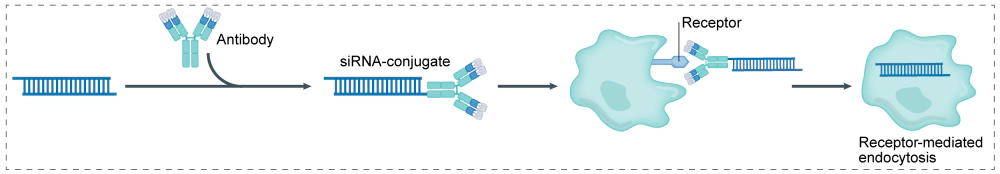
AOC的结构与ADC相似,主要由三部分构成:发挥组织靶向作用的载体,linker,作为payload的小核酸。AOC将抗体和小核酸有效地结合在一起,以实现靶向治疗,可以减少治疗疾病所需的药物量,同时解决不可靶向和小核酸药物的递送问题。与传统的小核酸疗法相比,AOC具有更好的药代动力学特性和更具特异性的生物分布。
小核酸药物由于其化学结构可修饰性强,可通过多种方法与抗体进行偶联。以下为制备AOC的四种常用方法:
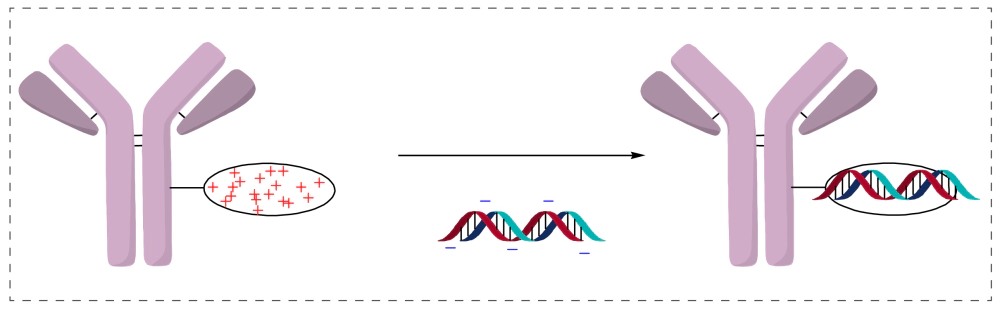
寡核苷酸主链带负电荷,鱼精蛋白带正电荷。将抗体或抗体片段(Fab或scFv)与鱼精蛋白构建成融合蛋白,通过鱼精蛋白的正电荷偶联带负电荷的寡核苷酸,形成抗体偶联寡核苷酸(antibody-oligonucleotide conjugates)。
优点:简单,灵活;且寡核苷酸进入细胞,多阳离子复合物可充当溶酶体逃逸剂。在溶酶体中,多阳离子复合物充当质子海绵,氯离子在内部扩散以补偿电荷不平衡,导致渗透膨胀,形成泄漏膜。这种溶酶体逃逸很重要,因为寡核苷酸没有强的膜通透性。
缺点:离子相互作用是可逆的、不稳定的;且难以确定DAR值。且鱼精蛋白的免疫原性较高,容易引发不良反应。
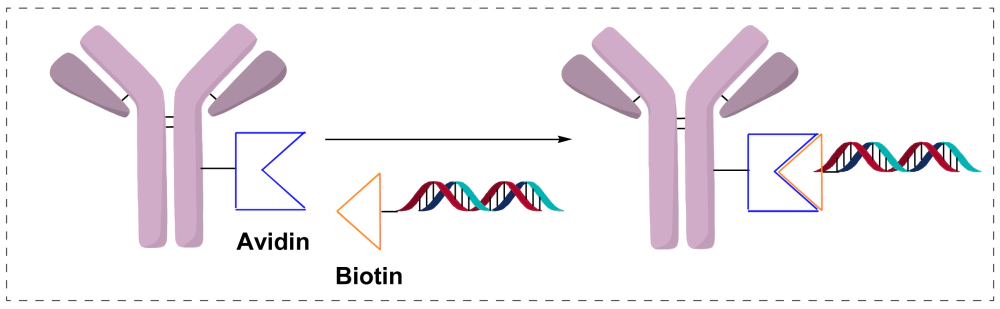
通过Avidin/Streptavidin−Biotin偶联:将硫醇修饰的DNA化学连接到马来酰亚胺激活的链霉亲和素上,生成链霉亲和素-DNA,进一步与各种生物素化蛋白非共价连接。主要应用于免疫检测方法开发。进一步发展,直接利用链霉亲和素的四个生物素结合位点,将生物素化的抗体和生物素化的寡核苷酸直接相连。
优点:操作过程相对简易、条件温和。
缺点:难以控制DAR值,血浆内不稳定。
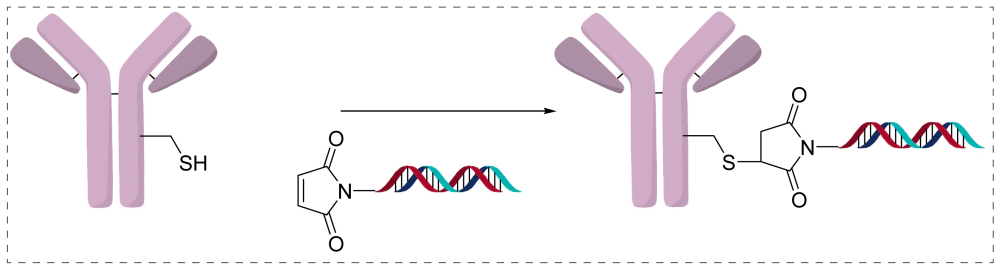
直接偶联是指在寡核苷酸上预先引入可反应基团,再与抗体的赖氨酸、半胱氨酸或工程化位点形成共价连接,是最接近ADC化学体系的AOC构建方式。为了不影响作用机制,修饰通常置于siRNA的sense strand。
优势:结构均一、化学稳定性高,并与既有ADC工艺体系高度兼容。Linker体积小、对抗体影响有限,可结合定点偶联实现精确控制DAR,使纯化、分析和放大生产更为可控。
局限:寡核苷酸本身对化学环境敏感,因此对linker的设计、修饰位置以及与双链退火过程的兼容性要求更高。直接偶联策略虽然可获得高度均质的AOC,但对化学修饰的精准度与序列工程提出更严格的条件。”
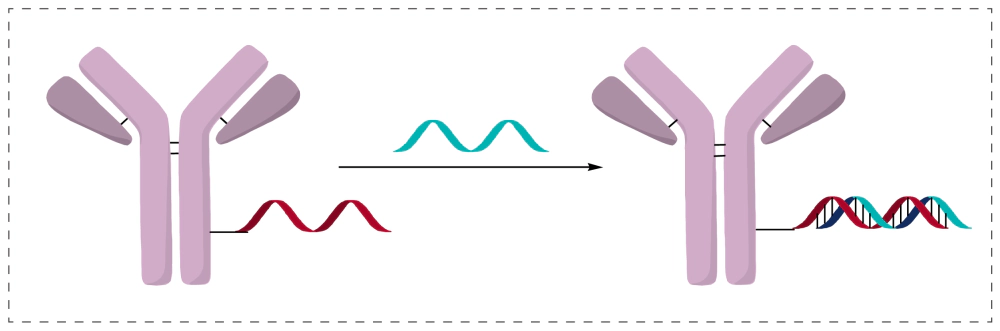
先将一条单链寡核苷酸以共价方式连接至抗体,再通过与其互补链的杂交形成双链结构,从而获得AOC。这种方法利用了核酸天然的碱基配对特性,使偶联过程无需直接在抗体上构建完整双链。
优势:对某些含有特殊结构或复杂化学修饰的核酸而言,杂交方式往往比直接偶联更易获得更高的制备产率与更温和的反应条件。由于只需在单链上引入可连接基团,互补链可通过杂交快速、定向地组装,大大减少了化学修饰对寡核苷酸本身构象与稳定性的影响,也为制备较长或结构敏感型寡核苷酸提供了更大的工艺弹性。
局限:双链长度与序列需精确优化:过短会导致杂交不稳定、影响最终AOC均一性;过长则可能产生二级结构,降低杂交效率。此外,该方法在放大生产时对杂交条件、双链比例和体内稳定性的要求更高,因此在实现高均一、高稳定性的工业化工艺上仍需更精细的设计与控制。
将抗体药物的组织特异性优势与小核酸的靶点特异性优势相结合,解决目前小核酸药物主要通过LNP、GalNAc递送系统靶向肝脏的问题,因此具备广阔的发展空间。
优势可概况为:1、具有靶向性,增加生物利用度,减少毒作用;2、提高稳定性,增加理想半衰期,提高有效性。
[1] Kalina Paunovska, et al. Drug delivery systems for RNA therapeutics. Nat Rev Genet. 2022 May;23(5):265-280. doi: 10.1038/s41576-021-00439-4.
[2]. Julien Dugal-Tessier, et al. Antibody-Oligonucleotide Conjugates: A Twist to Antibody-Drug Conjugates. J Clin Med. 2021 Feb 18;10(4):838. doi: 10.3390/jcm10040838.
[3]. Victor Lehot, et al. Non-specific interactions of antibody-oligonucleotide conjugates with living cells. Sci Rep. 2021 Mar 15;11(1):5881. doi: 10.1038/s41598-021-85352-w.
[4]. K Sreedurgalakshmi, et al. Cetuximab-siRNA Conjugate Linked Through Cationized Gelatin Knocks Down KRAS G12C Mutation in NSCLC Sensitizing the Cells Toward Gefitinib. Technol Cancer Res Treat. 2021 Jan-Dec;20:15330338211041453. doi: 10.1177/15330338211041453.
[5]. Nicole Bäumer, et al. Antibody-coupled siRNA as an efficient method for in vivo mRNA knockdown. Nat Protoc. 2016 Jan;11(1):22-36. doi: 10.1038/nprot.2015.137.
[6]. Hua Lu, et al. Site-specific antibody-polymer conjugates for siRNA delivery. J Am Chem Soc. 2013 Sep 18;135(37):13885-91. doi: 10.1021/ja4059525.
[7]. Patrick J Kennedy, et al. Antibodies and associates: Partners in targeted drug delivery. Pharmacol Ther. 2017 Sep;177:129-145. doi: 10.1016/j.pharmthera.2017.03.004.
[8]. Guizhi Zhu, et al. Aptamer-Drug Conjugates. Bioconjug Chem. 2015 Nov 18;26(11):2186-97. doi: 10.1021/acs.bioconjchem.5b00291.
[9]. Tsukasa Sugo, et al. Development of antibody-siRNA conjugate targeted to cardiac and skeletal muscles. J Control Release. 2016 Sep 10;237:1-13. doi: 10.1016/j.jconrel.2016.06.036
[10]. Asher Mullard. Antibody-oligonucleotide conjugates enter the clinic. Nat Rev Drug Discov. 2022 Jan;21(1):6-8. doi: 10.1038/d41573-021-00213-5.