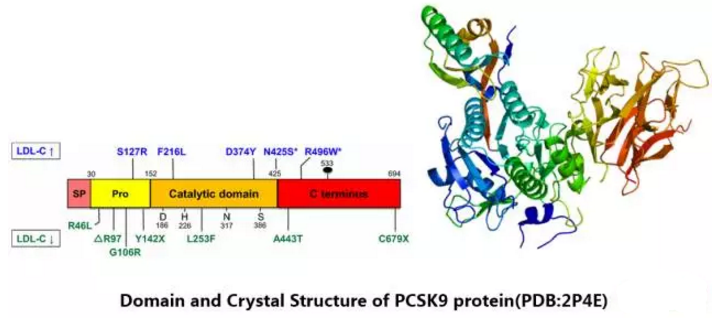
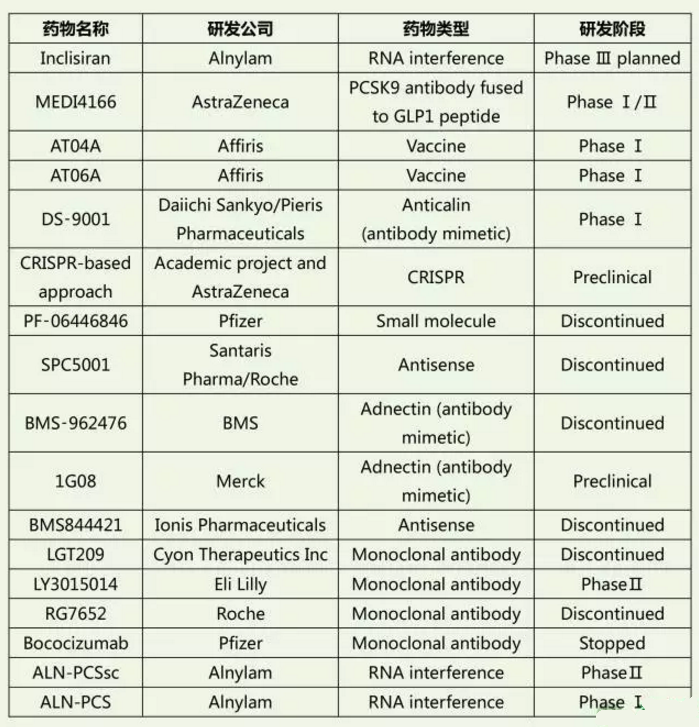
PCSK9简介
在过去近十年里,他汀类药物是降脂治疗的主力军,该类药物可以通过降低LDL-C进而减少心血管事件风险。近年来,PCSK9抑制剂成为脂质学药物研发领域一颗耀眼的明星,从分子机制阐明到相应药物上市仅10余年时间间隔。大量研究显示,该类药物可以显著降低LDL-C水平,多项临床终点试验也正在进行中。
2003年研究人员在一个法国家族中发现了PCSK9 (Proprotein convertase subtilisin / kexin type 9)的突变基因,这个基因也成为除LDLR和APOB之外的第三个与常染色体显性家族性高胆固醇血症有关的基因。PCSK9 cDNA长度为3617bp,编码692个氨基酸残基组成的PCSK9蛋白。PCSK9基因的功能获得性突变可导致常染色体显性的家族性高胆固醇血症,使得LDL受体水平下降,从而导致LDL-C水平的升高。常染色体显性的家族性高胆固醇血症与早发心血管疾病风险的增加密切相关。令人感兴趣的是,PCSK9基因丧失突变功能可出现低水平的血浆LDL-C和apoB。多项大型流行病学研究发现,PCSK9基因变异后出现丧失突变功能与心血管事件的发生关系越来越密切。
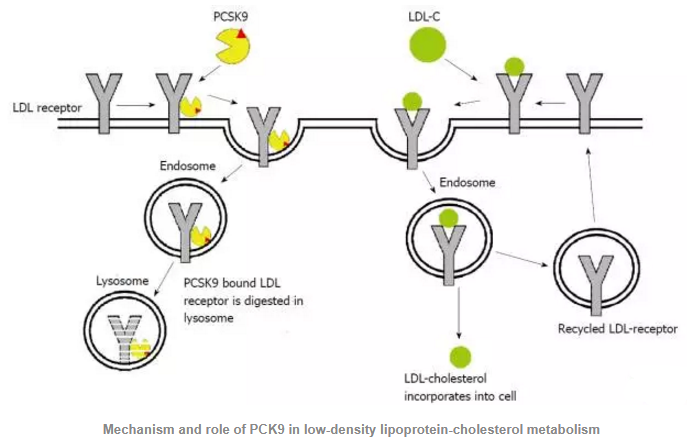
Mechanism and role of PCK9 in low-density lipoprotein-cholesterol metabolism
正常人体中,LDL-R与LDL-C结合后形成复合物,并由网格细胞胞吞入肝细胞内,然后LDL-R与LDL-C解离重新回到肝细胞表面。PCSK9能与LDL-C竞争性地结合肝细胞表面的LDL-R,PCSK9的催化结构域能与LDL-R的表皮生长因子A (epidermal growth factor A,EGF-A)相互作用形成复合物,PCSK9/LDL-R复合物进入肝细胞到达溶酶体降解LDL-R,防止LDL-R再循环到肝细胞膜表面。降低了肝细胞表面的LDL-R,LDL-C不能被肝脏清除,血液中的LDL-C水平升高。在编码PCSK9的基因发生功能获得型突变后可增加对LDL-R的降解,从而使肝细胞表面的LDL-R下调,血浆LDL-C水平升高。因此,抑制PCSK9的活性可以使血液中的LDL-C水平降低。
FDA批准的PCSK9抑制剂类药物
通过PCSK9抑制来降低LDL-C已成为药物研发热点。目前PCSK9抑制剂中最为成熟的是单克隆抗体类药物,其中Alirocumab以及Evolocumab已经被美国食品与药品管理局(FDA)和欧洲药品管理局(EMA)批准上市。
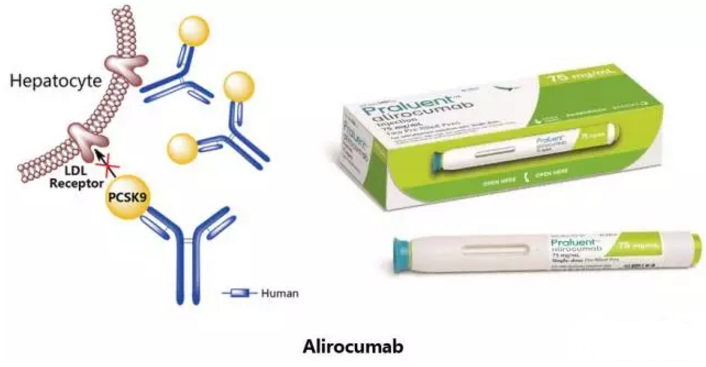
Alirocumab
由赛诺菲和再生元联合研发,于2015年7月24日获得美国FDA批准,2015年9月23日获得欧洲EMA批准,2016年7月4日获得日本PMDA批准上市,商品名定为Praluent。这是在美国获批的首个前蛋白转化酶枯草溶菌素9 (PCSK9)抑制剂类降胆固醇治疗药物。Alirocumab是一种全人源IgG1型单克隆抗体,作为PCSK9抑制剂,能结合PCSK9并抑制循环型PCSK9与低密度脂蛋白受体LDLR的结合,从而阻止PCSK9介导的低密度脂蛋白受体降解。该药物用于治疗成人杂合子型家族性高胆固醇血症和临床动脉粥样硬化心血管疾病(如需降低低密度胆固醇的心脏病或中风)。
Praluent是一种皮下注射用溶液,含75mg或150mg Alirocumab,推荐剂量为每次75mg或150mg,每两周一次。Praluent最常见的副作用包括瘙痒、肿胀、疼痛、注射部位挫伤、鼻咽炎及流感。过敏性反应如过敏性血管炎(一种皮疹,通常表现为皮肤上的紫色斑点,与小血管的炎症相关)及需要住院的超敏反应在使用Praluent的患者中有报道。如果患者经历严重过敏反应症状,应该停止使用该药并寻求医疗帮助。
在这一轮研发竞赛中,安进的Repatha (Evolocumab)和赛诺菲/Regeneron的Praluent (Alirocumab)处于领先地位。有意思的是,在美国市场,安进Repatha原本处于领先地位,但赛诺菲在冲刺阶段史无前例地花了6750万美元买了一张加速审评券,使Praluent审查周期从正常的10个月缩短至6个月,实现快道超越安进。
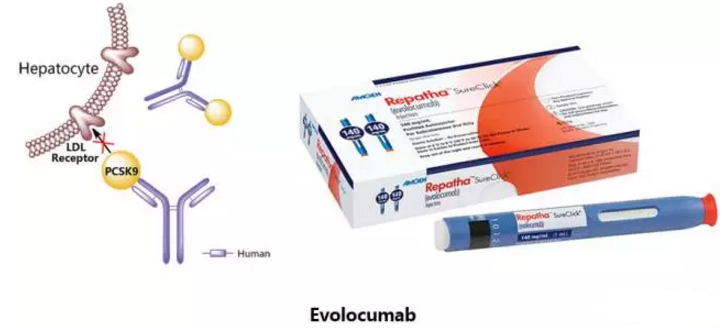
Evolocumab
由安进开发,于2015年7月17日获得欧洲EMA批准,2015年8月27日获得美国FDA批准上市,2016年1月22日获得日本PMDA批准,商品名为Repatha。Evolocumab是一种全人源IgG2型单克隆抗体,作为PCSK9的抑制剂,能够结合PCSK9并抑制循环型PCSK9与低密度脂蛋白受体LDLR的结合,从而阻止PCSK9介导的低密度脂蛋白受体降解。该药物批准的适应症为高胆固醇血症和混合血脂异常。
Repatha是一种皮下注射液,每支预填充的注射器含140mg/ml的Evolocumab,推荐剂量为每次140mg,每两周一次(成人原发性疾病)或每次420mg,每月一次(成人和12岁及以上儿童纯合子型家族性胆固醇血症)。Repatha的最常见副作用包括鼻咽炎、上呼吸道感染、流感、背痛和给予注射处的反应,例如发红、疼痛或淤伤。使用Repatha曾报道过敏反应如皮疹和荨麻疹,如出现严重过敏反应,患者应停止使用该药并寻求医疗帮助。
在研PCSK9抑制剂类药物及其分类
作为最引人关注的药物靶点之一,目前在研的PCSK9抑制剂类药物较多,简要按照不同研发策略总结如下:
单抗类药物
单克隆抗体药物是近年生物医药领域中的研发热点,具有靶向性强、特异性高和毒副作用低等特点,代表了药品治疗领域的最新发展方向。以PCSK9为靶标的单克隆抗体可以与PCSK9发生特异性结合,从而阻断PCSK9与LCLR的相互作用,减慢LCLR降解过程而发挥降低LDL-C水平的作用,也是最先取得突破的PCSK9抑制剂类药物研究策略。
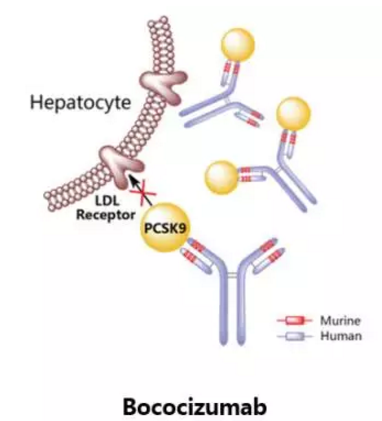
Bococizumab
辉瑞原研,是一种靶向于PCSK9的人源化IgGk型单克隆抗体,曾进行过治疗高胆固醇血症的临床三期研究,然而该项研究因结果未达预设终点而于2016年11月终止。辉瑞表示,通过对已获得的Bococizumab临床数据的全面评估,以及深度权衡降脂新药研发领域不断变化的市场格局,该公司认为Bococizumab不大可能为患者、医生及公司股东带来价值,因此决定终止Bococizumab的全球开发项目。
RG7652
Genentech原研,后于2009年转让给Roche,用于治疗包括带有高冠心病风险的高胆固醇血症。在2013年开展的一项二期临床试验中,RG752表现出良好的药物耐受性及显著的剂量依赖性疗效。尽管如此,由于至今未公开原因,Roche于2014年终止了该药物相关临床研究。
LY3015014
礼来原研。2016年初发表于《欧洲心脏杂志》一项二期研究发现,LY3015014(一种处于研究阶段的PCSK9抑制剂)联合标准降脂治疗能够安全有效的改善高胆固醇血症患者的血脂异常。
LGT209
Norvatis原研,后转让给Cyon Pharmaceuticals Inc用于开展对服用他汀类药物的高胆固醇血症患者的治疗效果。该研究目前已被终止。
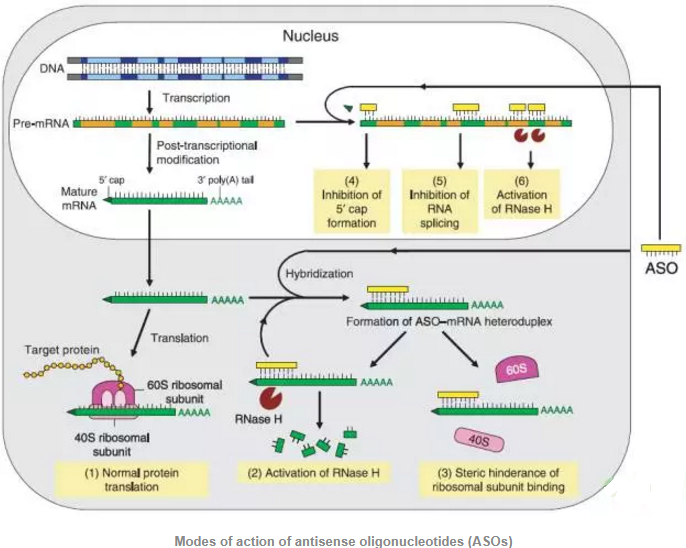
反义寡核苷酸类药物
Modes of action of antisense oligonucleotides (ASOs)
反义寡核苷酸(antisense oligonucleotide,ASO)通常指进行了某些化学修饰的短链核酸(约15-25个核苷酸组成),它的碱基顺序排列与特定的靶标RNA序列互补,进入细胞后可按照Watson-Crick碱基互补配对的原则与靶标序列形成双链结构。反义寡核苷酸与靶标基因的RNA结合后可通过各种不同的机制影响靶标基因的表达。反义寡核苷酸类PCSK9抑制剂类药物可以通过碱基互补原则结合于PCSK9靶基因mRNA上,从而封闭基因的表达,该类抑制剂在临床前研究中表现出了良好的效果。
SPC5001
Santaris Pharma原研,后于2014年被Roche收购。该药物在临床前研究中表现良好,曾处于临床一期研究,用于治疗家族性高胆固醇血症,但目前该项研究已经终止。
BMS844421
百时美施贵宝与Ionis研发,曾进入一期临床阶段,现已终止,原因不明。
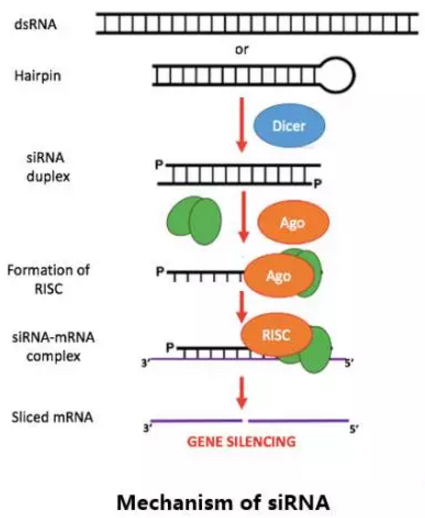
干扰小RNA类药物
干扰小RNA (siRNA)可经由多种不同转染技术导入细胞内,并对PCSK9基因产生具有专一性的基因敲除结果,在小鼠模型中可以显著降低LDL-C水平。Alnylam公司最早于2008年开始探索采用RNA干扰的方式阻止PCSK9蛋白的翻译,并在2014年通过一期临床研究证明其药物平台是安全有效的。
Inclisiran
Alnylam pharmaceuticals研发,采用Alnylam公司独特的化学修饰工艺合成的靶向PCSK9 mRNA的RNAi疗法。Alnylam公司将称为GalNAc的一种糖分子与小干扰RNA (Small Interfering RNA,siRNA)连接起来。这种经过修饰的siRNA不但更容易被细胞吸收,而且具备更高的稳定性,使得siRNA的疗效更持久。
在被称为ORION-1的临床2期试验中,497名高胆固醇患者在接受一次Inclisiran注射后的第60天,他们的LDL-C水平平均下降了51%,在接受注射后的第90天,LDL-C水平下降了45%。有189名高胆固醇患者在第1天和第90天分别接受了一次Inclisiran注射。这些患者在第120天LDL-C水平下降了57%,在第180天LDL-C水平下降了52%。这些指标与接受安慰剂治疗的患者相比有非常显著的统计学差异。这一结果意味着,高胆固醇患者一年可能只需要少数几次治疗就可以控制住他们的胆固醇水平。2017年3月17日,基于良好的二期临床表现,Alynylam Pharma宣布即将对Inclisiran开展三期临床研究并有望在今年启动,预计NDA申请将于2019年末左右提交。
ALN-PCS
Alnylam研发,静脉注射,目前处于临床一期研究阶段。研究结果显示,试验组和对照组治疗中不良反应时间发生率相同。ALN-PCS血药浓度分布迅速,血药浓度曲线大概以剂量成比例的方式增加。与对照组相比,ALN-PCS组别受试者血浆中PCSK9下降幅度平均为 70%,血浆中LDL水平下降幅度平均为40%。
ALN-PCSsc
Alnylam研发,皮下注射,目前处于临床二期研究阶段。初步试验结果表明该药物在降低胆固醇方面可以媲美两款最近获得批准的强效注射剂药物,并且其疗效可以持续更长的时间,这意味着它可能只需要每3-6个月给药一次即可。与基于抗体的竞争产品PCSK9抑制剂不同,它们作用于血液,而这款新的皮下注射剂是一种新类型的治疗药物,它能够阻止肝脏中与「坏」LDL胆固醇相关的蛋白的合成。
模拟抗体蛋白药
模拟抗体蛋白药是一种最新的生物治疗方法,由连接不同类型分子的纤维结合蛋白组成,模拟抗体与靶点部位相结合的部分。该类别的PCSK9抑制剂类药物可以通过阻断PCSK9与LDLR的EGF-A结构域的结合从而发挥PCSK9的抑制作用。
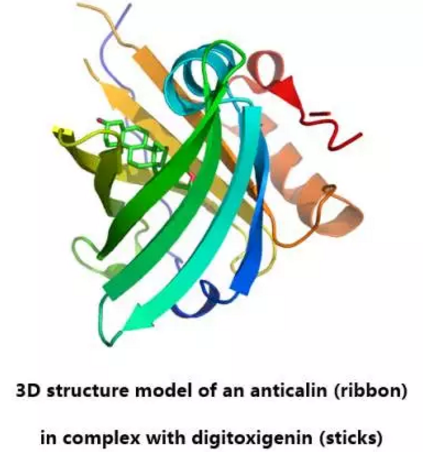
DS‑9001
Pieris原研,后转让给Daiichi Sankyo继续开发,目前处于一期临床研究阶段。Anticalin型蛋白为人工改造蛋白,可结合于蛋白或小分子等抗原。从结构上来说,Anticalin不同于抗体,属于抗体模拟物。该蛋白可发挥同单克隆抗体同样的功能,但分子量比一般抗体小8倍,通常由180个氨基酸残基构成,分子量大约20kDa。Anticalin技术由Pieris Pharmaceuticals公司研发,并申请了相关专利。
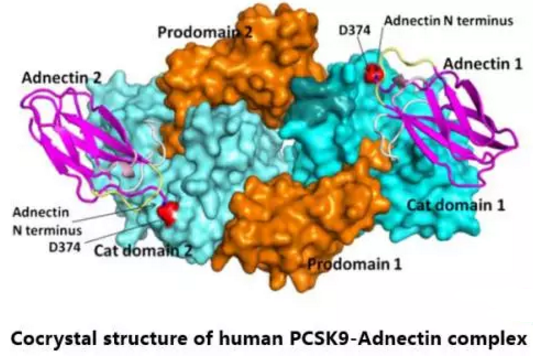
BMS‑962476
BMS原研,是PCSK9的Adnectin抑制剂,可作用另一种非抗体途径。BMS-962476分子量约为11.3kDa,由103个氨基酸残基组成。Adnectin是治疗性蛋白,靶点结合亲和力高,与抗体类似。第一个PCSK9的Adnectin抑制剂的研究显示,它可迅速降低血浆中PCSK9和LDL-C的水平,且Adnectin介导的抑制有很好的耐受性。
1G08
Merck原研,为人类抗体-抗原结合片段,主要作用于PCSK9羧基末端结构域。与众不同的是,1G08并不影响PCSK9与LDLR间的相互作用,而主要抑制PCSK9-LDL-R复合体的内吞过程而发挥活性。
小分子抑制剂类药物
目前小分子PCSK9抑制剂类药物的研发刚刚起步,尚处于生物活性研究阶段。PCSK9这类靶点传统上是不适合开发小分子的,它没有像酪氨酸激酶那样的天然口袋,结合界面相对来说比较开放、平坦,小分子接触面积有限,产生的疏水作用力也不会太强(实际上小分子可能没有被蛋白质包裹,直接裸露在水相环境中),即使结合上去了,被天然的大分子配体一碰可能就解离。
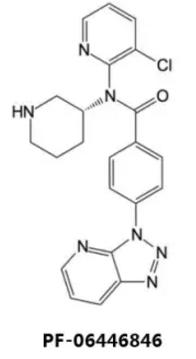
PF‑06446846
Pfizer公司建立了自己的表型筛选平台来筛选可阻断PCSK9分泌进入血液的药物,在250万种化合物中筛选到了PF-06446846,也是唯一达到预设药效和毒性阈值的Hit;随后用了约5年时间阐明了该化合物作用的分子机制。功能研究表明,该化合物可结合于核糖体及刚翻译出的PCSK9分子上,并阻塞核糖体退出通道,从而封闭PCSK9的产生。很多天然产物及抗生素也会抑制核糖体功能,但通常不具有特异性。而PF-06446846则与此不同,只对包括PCSK9在内的约20种蛋白具有高度选择性,且作用机制在从酵母到人类的真核生物中具有保守性。出于商业考虑等因素,目前Pfizer已终止了该药物的研发,但随着PCSK9研究的深入,希望之门并未完全关闭。
其他类别
MEDI4166
MedImmune原研,于2007年被阿斯利康收购,PCSK9抗体与GLP1多肽融合蛋白类药物。目前处于临床二期阶段,用于治疗成人2型糖尿病与心血管疾病。
AT04A
Affiris原研,疫苗类PCSK9抑制剂,目前处于一起临床研发阶段,适应症为动脉粥样硬化。在2016年9月发表的一项研究报告中,AT04A能显著降低小鼠模型的血液总胆固醇、甘油三酯及低密度脂蛋白浓度,降低血清中肝脏炎症标志物含量,从而改善动脉粥样硬化病情。
AT06A
Affiris原研,疫苗类PCSK9抑制剂,目前处于一起临床研发阶段,适应症为动脉粥样硬化。Affiris公司一直致力于慢性病的疫苗类药物开发,如帕金森及阿尔茨海默病等神经退行性疾病。
CRISPR-based approach
CRISPR技术有望实现“一劳永逸”的治疗方式。来自Harvard大学的Kiran教授领导的团队目前正致力于采用CRISPR-Cas9技术来降低PCSK9水平,小鼠实验中可降低LDL-C达40%,且后续试验表明,该策略在携带有人源化肝脏的嵌合体小鼠中同样表现出色。制药公司AstraZeneca同样可开展了利用CRISPR技术抑制PCSK9的研究,相关结果有望近期发表。
前景与展望
以PCSK9为代表的新的降脂靶点受到越来越多的关注。科研界及医药工业界近十年的研发工作,使得PCSK9抑制剂的临床研究取得了令人欣喜的进展,并在抗体药物领域率先取得突破成为革命性降脂药物。目前以单克隆抗体为代表的的生物制剂研发是新药研发的热点,在研的PCSK9抑制剂类抗体药物也有多种。由于抗体药物为注射剂型,而不是传统的固体剂型,因而治疗成本较高,且患者适应性也需要进一步的临床观察。但PCSK9抑制剂的研发将为降脂治疗提供新的视角,尤其是对于他汀类药物抵抗、难治性高胆固醇血症患者,PCSK9的临床疗效显的更加明显,长期安全性和耐受性良好,具有广阔的临床应用价值和前景。


















 相关新闻
相关新闻