为鼓励研究创制新药,提升我国自主创新能力,加强药品注册管理,加快具有临床价值的新药和临床急需仿制药的研发上市,国家开启了“特殊审批”、“重大专项”、“优先审评”等药品的特殊审批通道。
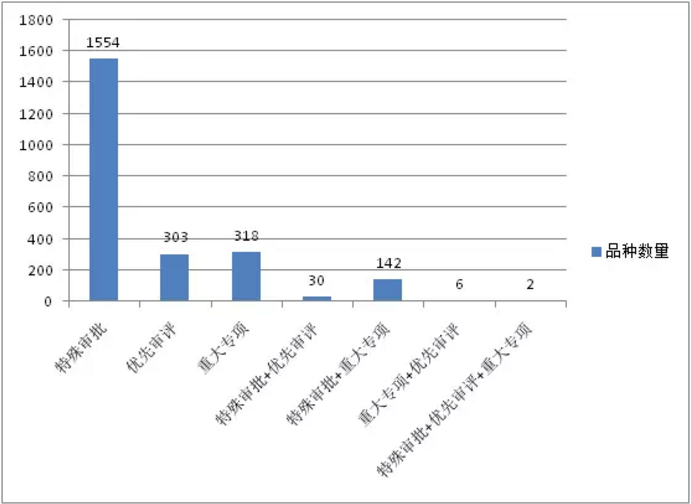
根据药智数据统计,国家药品审评中心(CDE)历年受理的“特殊审批”、“重大专项”、“优先审评”品种数量走势如图1、2所示。“特殊审批”相关受理号从2004年开始出现,截止2017年6月30日,累计受理1554个特殊审批品种(按受理号计,下同);2005年开始出现“重大专项”相关受理号,截止6月30日累计受理318个重大专项品种;“优先审评”相关受理号从2010年开始出现,截止6月30日累计受理303个优先审评品种。从受理品种数量来看,特殊审批品种远超优先审评、重大专项品种,是其受理数量总和的2.5倍之多。
图1:“特殊审批”、“重大专项”、“优先审评”品种数量及组合数量
注:“特殊审批+优先审评”:既是特殊审批又是优先审评的品种;“特殊审批+重大专项”:既是特殊审批又是重大专项的品种;“重大专项+优先审评”:既是重大专项又是优先审评的品种;“特殊审批+优先审评+重大专项”:既是特殊审批又是优先审评还是重大专项的品种。
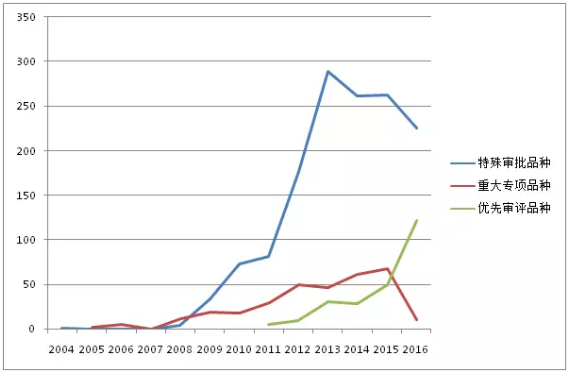
图2:CDE历年受理的“特殊审批”、“重大专项”、“优先审评”品种走势
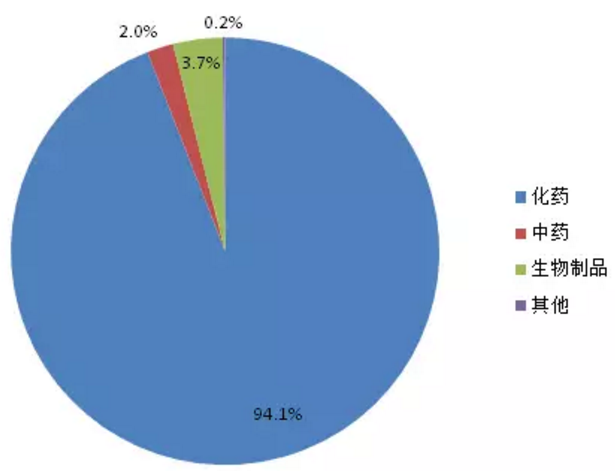
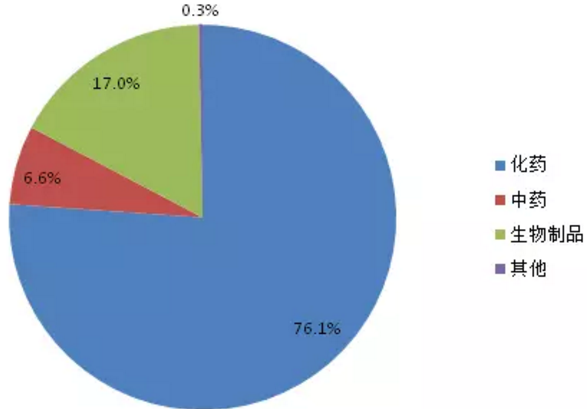
特殊审批品种自2004年出现第1个受理号后,2005-2007年期间没有品种被受理,直到2008年。2008-2013年之前受理数量一直处于快速增长阶段,2013年达到峰值289个,2013年之后三年期间受理数量开始下滑。2017年上半年受理146个品种。1554个特殊审批品种大多为化药(如图3所示),占比高达94.1%,其他类型药品仅占5.9%。
重大专项品种受理数量在2015年之前一直呈现出波浪式上升趋势,2015年达到峰值67个。但2016年仅10个品种被受理,2017上半年也未有品种被受理。318个重大专项品种各药品类型占比如图4所示,中药占到6.6%。
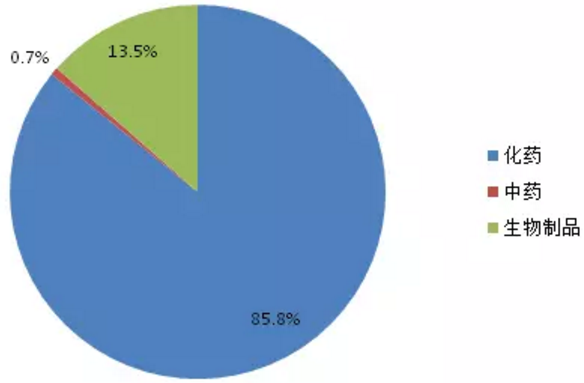
优先审评品种开始受理的5年期间,受理数量一直呈现上升趋势,2016年更有122个品种被受理。2017上半年也有58个品种被受理。303个优先审评品种按药品类型分类,化药仍占主导地位(如图5所示),占比达85.8%,生物制品占13.5%。
图3:特殊审批品种药品类型占比
图4:重大专项品种药品类型占比
图5:优先审评品种药品类型占比
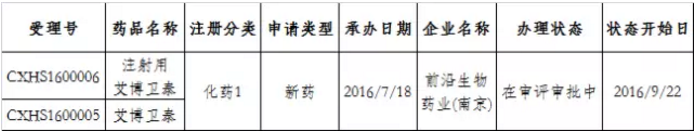
截至目前,前沿生物药业(南京)股份有限公司的化学1类新药“艾博卫泰”及制剂“注射用艾博卫泰”是CDE唯一受理的既是“特殊审批”又是“优先审评”还是“重大专项”品种。2016年7月被受理,目前还在审评审批中(如表1所示),系复方类治疗HIV感染的抗病毒药物,也是全球第一个长效HIV融合抑制剂。
表1:既是“特殊审批”又是“重大专项”还是“优先审评”的品种
2017上半年CDE受理的特殊审批品种分析
截止6月30日,2017上半年CDE受理特殊审批品种146个,按不同分类方式细分如下:
药品类型:化药145个,生物制品1个,无中药等其他类型;
申请类型:新药120个,进口26个,无仿制药等其他类型;
注册分类:化药1类140个,化药2.4类3个,化药1.1类2个,预防用生物制品1类1个;
办理状态:在审评的有132个,制证完毕-已发批件的有14个。
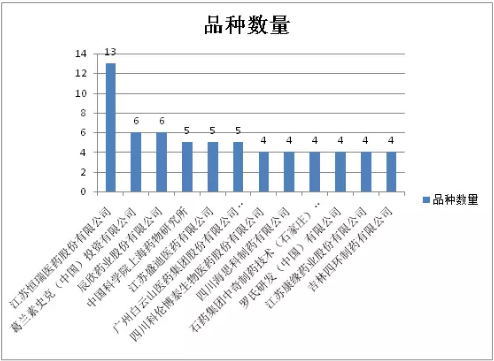
特殊审批品种数量≥4的企业及分属品种数如图6所示,排名居前的企业大多为国内制药企业,江苏恒瑞远居榜首,有13个品种被受理,跨国企业仅葛兰素史克(中国)一家。
图6:特殊审批品种数量≥4的企业及分属品种数
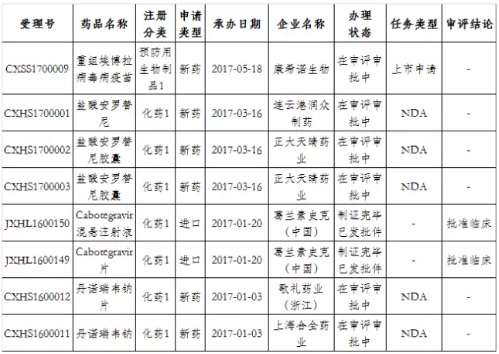
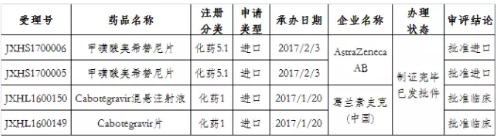
值得一提的是,在这146个品种中,有8个既是特殊审批又是优先审评品种,其中Cabotegravir混悬注射液和Cabotegravir片已获批临床,两个品种申请类型均系进口(如表2所示)。
表2:8个既是特殊审批又是优先审评的品种
2017上半年CDE受理的优先审评品种分析
截止6月30日,2017上半年CDE受理优先审评品种58个,按不同分类方式细分如下:
药品类型:化药46个,生物制品12个,无中药等其他类型;
申请类型:新药11个,仿制药15个,进口29个,补充申请3个;
注册分类:化药1类8个,化药3类4个,化药5.1类17个,化药6类10个,治疗用生物制品6个,治疗用生物制品15类1个,治疗用生物制品9类1个,预防用生物制品1类1个,预防用生物制品9类1个;
任务类型:NDA申请14个,ANDA申请15个,IND申请3个,上市申请7个,临床试验申请2个,补充申请(临床)2个,验证性临床3个;
办理状态:在审评的有53个,制证完毕-已发批件的有4个(2个批准临床,2个批准进口,如表3所示)。
表3:4个制证完毕-已发批件的优先审评品种
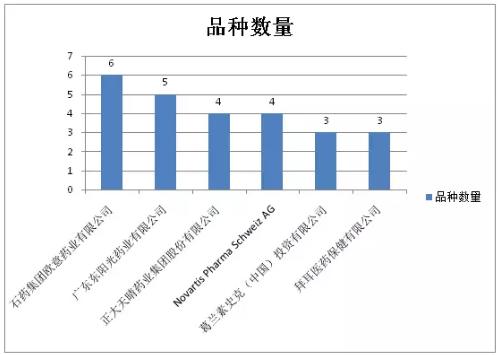
去除补充申请后,优先审评品种数量≥3的企业及分属品种数如图7所示,国内、跨国企业各占半壁江山。冠军和亚军分别为石药集团欧意药业和广东东阳光药业。
图7:优先审评品种数量≥3的企业及分属品种数









 相关新闻
相关新闻