



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




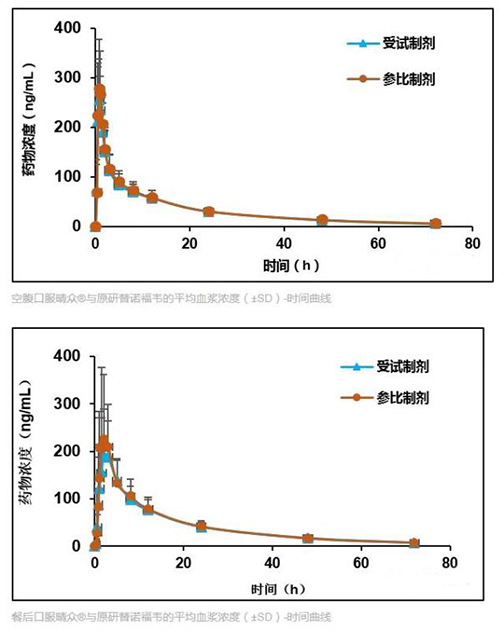
12月5日,中国生物制药有限公司发布公告,集团子公司正大天晴开发的富马酸替诺福韦二吡呋酯片(替诺福韦)获得CFDA的药品注册批件,用于治疗慢性乙型肝炎成人和12岁及以上的儿童患者。值得注意的是,该药同时是首个按照仿制药质量和疗效一致性评价标准完成生物等效性研究,并通过与原研药进行头对头对照临床实验的仿制药。
正大天晴的替诺福韦获批上市可谓一波三折。2012年,正大天晴以6类申报替诺福韦,2015年以3.4类申报,但最终3.4类和6类的申报均撤回,2016年10月按照新注册分类的4类进行了申报,终于日前获批注册。
据悉,正大天晴于2007年就开始对替诺福韦酯进行项目立项与处方工艺研究,该项目还获得了“十二五”“重大新药创制”科技重大专项支持。历经10年,正大天晴替诺福韦与原研替诺福韦杂质谱、体外溶出行为等主要药学指标一致,实现了质量一致性。
数据显示,我国约有1亿左右的人群为乙肝病毒携带者,约占我国总人口数的8%~10%,慢性乙肝患者约2000万人。近年来,我国治疗乙肝用药的市场规模快速增长。数据显示,2011年我国乙肝药市场规模为68.81亿元,2015年增长至162.76亿元,CAGR达22.4%。预计到2020年我国乙肝用药市场规模将达到200亿元。
在乙肝治疗领域,目前上市的主要治疗产品有2种,即干扰素α和核苷类似物,临床使用越来越以核苷类药为主,已占乙肝用药市场的80%。核苷类目前应用的主要有恩替卡韦、拉米夫定、阿德福韦酯、替比夫定、替诺福韦等。其中,恩替卡韦和替诺福韦由于疗效好、低耐药等优势,被2015年版《慢性乙型肝炎防治指南》中推荐为慢乙肝治疗的首选药物。
替诺福韦的原研是吉利德开发上市的核苷酸类抗病毒药。2001年美国获批用于HIV治疗,2008年在欧盟与美国获批用于HBV治疗并进入中国,由GSK特许销售。2014年,该产品国内获批乙肝适应症。
根据智研咨询数据,2015年,我国核苷类抗乙肝病毒化学药市场主要品种中,恩替卡韦成为同类产品的老大,该品种2015年销售额为79.42亿元,市场份额为60.01%,占据了大部分市场。其次为阿德福韦酯,2015年市场份额为20.05%。恩替韦卡也是正大天晴的重要的得力产品,2016年,正大天晴该产品销售额突破35亿元,以42%市场份额跃居第一。此番替诺福韦获批,再结合正大天晴阿德福韦酯、马来酸恩替卡韦等其他产品,将大大增强正大天晴在保肝药市场的实力。
当前在本土企业中,除了正大天晴,产品线中有布局替诺福韦片的还包括广生堂、成都倍特、齐鲁制药和安徽贝克。成都倍特的产品于2016年11月23日获得替诺福韦原料及片剂生产批件,获批的是HIV适应症,正补充申请增加乙肝适应症;2017年5月,齐鲁制药及广生堂的原料药及片剂获批生产。
总体来看,替诺福韦未来在国内市场将呈现快速增长趋势。根据国内样本医院数据统计,替诺福韦2012年销售额为242万元,2015年销售额为2509万元。由于2016年5月国家药品价格谈判结果,替诺福韦2016年迅猛增长,销售额高达1.14亿元,同期增长354.1%。已进入新版医保目录的替诺福韦未来的市场份额将继续扩张,很有可能撼动当前国内乙肝药市场格局。
虽然替诺福韦未被列入CFDA要求在2018年底前必须完成一致性评价的289目录中,但正大天晴提早布局,获批上市同时也通过一致性评价。这也反映出,仿制药一致性评价大政策已在行业中竖起无形的警示牌,新品仿制药越来越注重提升质量。
临近2018大限,各企业对自身仿制药一致性评价工作进展也越来越清晰。为了节省资金和时间成本,很多中小企业度不得不选择放弃相关品种,投入到最有希望争夺市场的品种中去。根据CFDA公布的289品种开展一致性评价情况,表示不放弃评价的企业占57%,但已开展评价的企业仅占26%。
11月29日,总局食品药品核查中心发布工作动态称,11月23日启动了首批7个仿制药一致性评价品种的有因现场检查工作。感觉国泰君安统计数据,截止2017年12月,有44个国内已上市仿制药的一致性评价、15个出口转内销、9个撤回重报申请,三大路径共计68个申请,第一批品种获批临近,预计有望在2017年底或2018年初通过。
在一致性评价工作开展的同时,国办和CFDA制定了多项通过评价后的鼓励政策,鼓励的同时也在催促着行业的大洗牌。
在采购方面同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种,未超过3家的,优先采购和使用已通过一致性评价的品种。
在医保支付方面,有关部门将加快按通用名制订医保药品支付标准,尽快形成有利于通过一致性评价仿制药使用的激励机制。此外,通过一致性评价药品生产企业的技术改造,若条件符合还可申请相关资金支持。招标采购、医保作为产品放量的重要渠道,无疑,越早通过一致性评价工作,企业越能抢占市场先机,而错失市场的企业很可能被自然淘汰。
此外,专家分析,一致性评价将推动优质国产仿制药替代进口产品。一直以来,广大患者群体偏向于选择疗效佳的进口原研药,由于国产仿制药与原研药之间质量和疗效不一致,国产仿制药无法对已过专利期的原研药品发起有力冲击。
药品集中采购7号文后的新一轮招标中,多地通过降低原研药质量层次,或将仿制药一致性评价药品、首仿药、规模企业药品、欧美日上市销售等药品与原研药列入同一质量层次,以增强国产优质药品对原研药的价格挑战,加快进口替代。此前,10月20日,CDE曾发布关于征求《首批专利到期、终止、无效尚且无仿制申请的药品清单》,这也是进一步鼓励专利挑战,引导仿制药研发生产的信号。
 相关新闻
相关新闻