序言
“挑战专利不是技术问题,也不是法律问题,它是一种商业策略”。
------TEVA CEO 2006
由于制药行业的“专利翘尾价值”,即专利药一般在专利到期前达到销售峰值,仿制药公司的专利挑战显得商业价值极大。不管是TEVA还是Mylan,无不是通过专利挑战而声名鹊起,迅速发展壮大,奠定自己在仿制药江湖的老大地位。专利挑战是任何一家有野心的仿制药公司不可回避的一个商业选择。
仿制药专利挑战背景
1984年《药品价格竞争和专利期修正案》(Hatch-Waxman Amendment)和2003年颁布的《医疗现代化法》(Medicare Modernization Act,MMA),为仿制药申请提供了便捷的路径,即505(j):申请包含信息证明拟申报药物与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应症等。
505(j)被称为简略新药申请(ANDA),即所谓的仿制药申请,又称“拷贝型”仿制药。Hatch-Waxman法案规格,仿制药公司在提交ANDA申请时,需递交针对RLD在橙皮书上公开登记专利的四种申明之一:
Ⅰ:该新药在橙皮书中无相关专利登记信息;
Ⅱ:该新药在橙皮书中相关药物的专利已经过期;
Ⅲ:在橙皮书中相关药物的专利过期前,不要求FDA批准该仿制药;
Ⅳ:橙皮书中相关药物的专利是无效的,或仿制药的生产、使用、销售不侵犯专利药的专利。
其中,对于第Ⅳ声明,即仿制药公司对原研药品相关专利提出挑战。本文将通过美国仿制药公司典型的专利挑战案例,为国内仿制药公司进行专利挑战提供借鉴。
橙皮书中RLD的专利全景图
FDA橙皮书规定了RLD登记的专利范围,具体如下表所示:
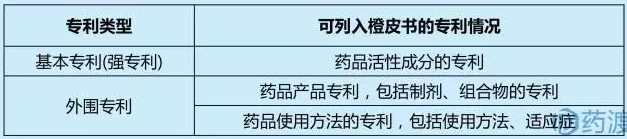
联邦条例314.53规定,新药的专利声明信息根据FDA3542a表与NDA申请同时递交;对于NDA批准后被授权的专利,申请持有人需在30天内通过FDA3542表向FDA进行专利备案。所有通过FDA3542表提交的专利将在FDA橙皮书中相关新药资料中予以公开出版。表FDA3542明确规定了不可列入橙皮书的专利情况,主要包括:
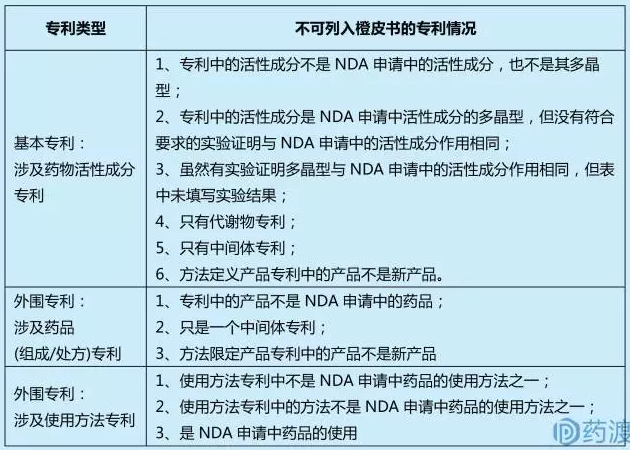
通过分析FDA橙皮书允许登记新药专利范围的限定,FDA橙皮书上登记的专利主要与NDA申报的新药密切相关;不论是活性成分专利还是制剂、用途专利均需要得到NDA申报相关资料数据的支持,否则橙皮书中将不予收录。
仿制药公司的专利挑战典型路径
根据Hatch-Waxman法案,仿制药公司在提交ANDA申请时,仅需对RLD在橙皮书上公开的专利进行声明;仿制药公司进行专利挑战时,也仅需对橙皮书上公开的专利进行挑战,挑战成功即可获批上市并同时获得首仿的180天市场独占。
根据仿制药专利挑战即第Ⅳ声明的定义,仿制药公司的专利挑战主要包括两大策略:1)RLD在橙皮书中登记的相关专利无效;2)仿制药不侵犯RLD在橙皮书中登记的相关专利。针对橙皮书上不同类型的专利,挑战策略如下表所示:
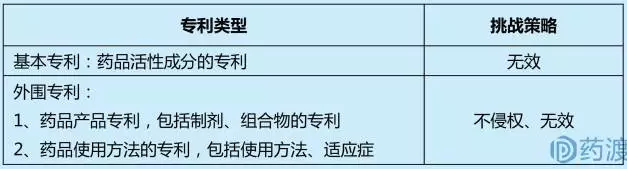
Hatch-Waxman法案规定,通过505(j)途径申请(ANDA)的仿制药应与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应症等。由于药品的活性成分基本无法规避,所以针对基本专利一般通过专利无效进行挑战;而对于制剂等外围专利的挑战,主要通过不侵权和无效相结合进行专利挑战。Grabowski统计了1994年到2006年高价值专利药的诉讼,并且按照专利分类对诉讼结果进行了统计:
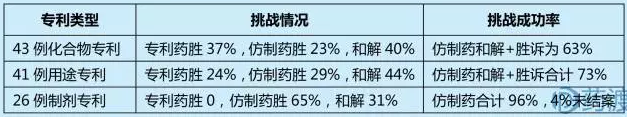
由于化合物专利为强专利,挑战难度较大,可选择化合物专利到期后挑战其他重要的外围专利,从而获得首仿权是大多数仿制药厂商的重要策略。接下来将分别介绍不同专利类型的挑战案例。
药品活性成分的专利挑战
针对橙皮书上登记的药品活性成分专利主要采取专利挑战策略一,即专利无效。美国的专利无效是一个复杂的制度,主要包括行政途径和司法途径。行政途径指的是通过向USPTO提出单方面再审、双方重审和授权后重审。司法途径指的是向法院提出诉讼并由法院进行判定的方式,主要手段包括:1)提起专利权确认诉讼;2)侵权中反诉无效;3)侵权中提起专利权抗辩。两种途径各有优势,在实际应用中,两种途径交叉使用以增加获胜概率。
案例:
背景知识
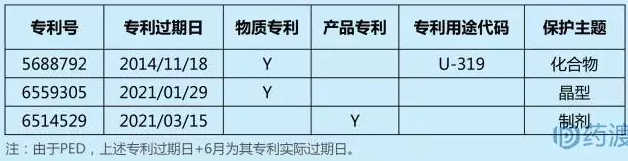
利奈唑胺( linezolid,商品名:Zyvox)是用于治疗革兰阳性菌感染的药物,FDA于2000年4月18日批准其上市,2014年全球销售额高达14亿美元。原研法玛西亚普强公司(后被辉瑞收购)申请利奈唑胺相关专利30余项,请求保护的主题涉及化合物、制剂、适应证、联合用药和制备方法等。橙皮书中共登记了化合物、制剂和晶型3项重要专利。
 专利挑战
原告:辉瑞(原研公司)
被告:TEVA(仿制药公司)
专利挑战
原告:辉瑞(原研公司)
被告:TEVA(仿制药公司)
2009年12月,梯瓦向美国FDA提出200mg/100mL利奈唑胺注射剂的ANDA 申请。在提交专利声明时,梯瓦公司提出对化合物专利US5688792(下称792专利)专利无效、不可实施及仿制药申请并不侵犯792专利。通过文献调查,792专利为在先专利申请(WO9323384)的改进创新成果,无论是基于化合物的显而易见性,还是预料不到的技术效果,均存在较大的质疑空间,为挑战792专利的专利权稳定性提供了机会。2012年5月29日,辉瑞与梯瓦就侵权之争达成和解协议:辉瑞对梯瓦的利奈唑胺发放许可,梯瓦承认792专利的有效性。FDA在30个月后批准了梯瓦的利奈唑胺注射制剂,辉瑞将792专利部分许可给了梯瓦,但仅限于该化合物专利的注射制剂用途,而不允许延及固体片剂,即在专利到期前36个月额外给予梯瓦利胺唑胺注射液仿制药的美国销售权。
药品产品的专利挑战
药品产品专利属于外围专利,其保护强度较化合物专利低,容易被仿制药公司绕开或无效。仿制药公司在ANDA申请时,常采用专利挑战策略二,即专利不侵犯。在专利侵权判定中,等同原则是一项重要原则。作为被告的仿制药企业,经常需要对原研公司所提出的侵权行为进行抗辩。仿制药公司可以通过以下四种准则对侵权诉讼进行抗辩:①全部技术特征准则;②现有技术的限定准则;③禁止反悔准则;④公共贡献准则。
案例:
背景知识
莫西普利是一种血管紧张素转换酶(ACE)抑制剂,原研公司为华纳兰伯特,后独家许可给Schwarz公司。盐酸莫西普利(MH)是莫西普利的盐酸盐,是Schwarz的品牌药Univasc中的活性成分。橙皮书中登记了1 项组合物专利。
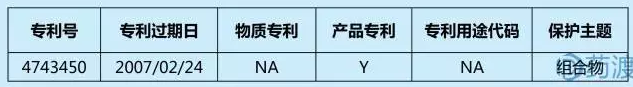
专利4743450(下称450)名称为“稳定的组合物”,于1988年5月10日公告授权。该专利涉及的药物组合物包括:ACE抑制剂盐酸莫西普利和阻止其降解的稳定剂。没有稳定剂,盐酸莫西普利会经环合而降解、因氧化而变色以及水解。专利450提供了一种“使用一种碱金属或碱土金属碳酸盐来抑制环合反应和变色”组合物的方法。<














 相关新闻
相关新闻