近十年,FDA通过快速审批批准的抗肿瘤药有27个,其中10个用于治疗肺癌、卵巢癌、乳腺癌等,替尼类药物就有4个,发展突飞猛进。
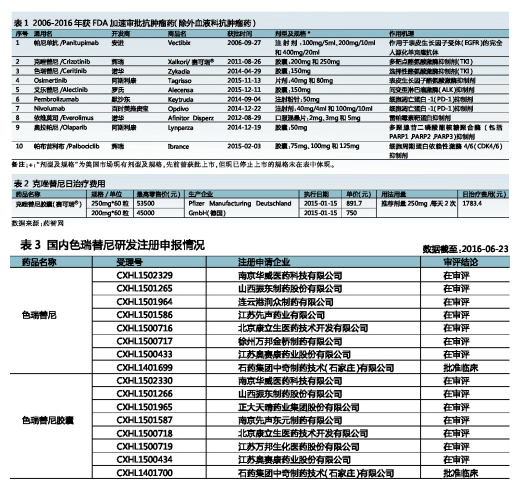
2006-2015年,美国FDA通过快速审批批准的抗肿瘤药物有27个,其中血液科抗肿瘤药17个,其它抗肿瘤药如治疗肺癌、卵巢癌和乳腺癌等的药物10个。10个其他抗肿瘤药物中,有3个生物类药物,7个新分子实体。值得一提的是,在7个新分子实体中,竟有4个替尼类药。可见,自首个小分子靶向抗肿瘤药伊马替尼于2001年问世以来,替尼类抗肿瘤药发展突飞猛进。
4个替尼类抗肿瘤药均用于治疗肺癌,分别是:辉瑞的克唑替尼、诺华的色瑞替尼、罗氏的艾乐替尼和阿斯利康的Tagrisso(Osimertinib)。其中,克唑替尼、色瑞替尼和艾乐替尼适用于ALK融合基因阳性的非小细胞肺癌(NSCLC)患者,而Tagrisso则适用于经表皮细胞生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗时或治疗后病情进展的T790M突变阳性的NSCLC患者。可以说,Tagrisso的问世为T790M耐药突变的治疗掀开了崭新一页。来自阿斯利康公司企业报告数据显示,Tagrisso仅上市1个多月销售额已达0.19亿美元,市场潜力凸显。曾有分析师预测Tagrisso的销售额峰值有望达30亿美元。此外,所获批的3个生物类药物中,有2个用于治疗黑色素瘤(见表1)。
ALK抑制剂
肺癌是世界上死亡率最高的恶性肿瘤之一,全球每年新增肺癌病例120万人,因肺癌死亡约150万人。每年经确诊的新肺癌患者中,非小细胞肺癌(NSCLC)患者比例高达85%,而其中又有70%的患者在确诊时已存在局部晚期或远处转移。有数据显示,在NSCLC患者中,ALK融合基因阳性的发生率为5%。中国NSCLC患者ALK融合基因阳性的发生率为3%~11%。
近年来,我国肺癌的发病率和病死率均显著升高。国家癌症中心2015年发布的数据显示,2006-2011年我国肺癌5年患病率是130.2(1/10万)。其中男性84.6(1/10万),居恶性肿瘤第2位。女性45.6(1/10万),居恶性肿瘤第4位。预计到2025年,我国肺癌患者将达100万,每年新发ALK融合基因阳性NSCLC病例数近35000例,成为全球第一肺癌大国。
临床上传统化疗法治疗晚期或转移性NSCLC并不理想。2004年,NSCLC中活化表皮细胞生长因子受体(EGFR)突变及其与EGFR酪氨酸激酶抑制剂(EGFR TKIs)临床效应相关的发现拉开了肺癌分子靶向治疗的帷幕。目前,临床上已将EGFR TKIs作为治疗特定基因亚型的晚期NSCLC的标准药物之一。但是,并非所有EGFR激活突变的NSCLC患者对EGFR TKIs均疗效显著。间变性淋巴瘤激酶(ALK)突变的NSCLC引起医学界的高度关注,因此而诞生的首个ALK抑制剂克唑替尼不但为ALK融合基因阳性NSCLC患者的治疗提供了新的选择,还促进了该类药物的发展。
1.克唑替尼
克唑替尼是一种包括ALK、肝细胞生长因子受体(c-Met、HGFR)和酪氨酸激酶受体(RON)的抑制剂,通过抑制ALK和c-Met磷酸化阻断肿瘤细胞生长和存活,用于ALK阳性的晚期NSCLC患者。克唑替尼对ALK和cMet具有高度选择性,选择性至少是其它激酶的20倍。
值得一提的是,2016年3月11日,FDA还批准克唑替尼用于治疗ROS-1基因突变的转移性NSCLC患者,从而成为FDA批准的首个用于治疗ROS-1阳性NSCLC的治疗药物。总之,克唑替尼作为首个靶向ALK抑制剂,其临床应用标志着NSCLC的治疗由传统模式转向通过生物标记物决策的治疗模式。克唑替尼现已在全球近80个国家获批上市,CFDA也于2013年1月22日批准克唑替尼用于ALK阳性晚期NSCLC患者的治疗。如今,克唑替尼已成为 ALK 融合基因阳性NSCLC一线治疗药物。
克唑替尼已进口中国,但价格昂贵(有关克唑替尼的日治疗费用详见表2)。据了解,连云港润众制药有限公司开发的克唑替尼原料药(受理号:CXHL1402001),以及正大天晴药业集团股份有限公司开发的克唑替尼胶囊(受理号:CYHS1401801和CYHS1401802)已获临床批文。可见,克唑替尼国产化指日可待。
EvaluatePharma数据显示,2015年克唑替尼全球年销售额为4.88亿美元,同比增长11%。据IMS数据,2015年我国22城市样本医院克唑替尼年销售金额为5480.9万元,同比增长147.8%,成为我国替尼类药物中快速增长的品种之一。
2.色瑞替尼
尽管克唑替尼在ALK阳性NSCLC患者获得良好的无进展生存和客观有效率,但由于EML4-ALK的ATP结合位点附近基因突变,基因扩增、信号通路的旁路激活以及肺癌脑转移等因素影响,大部分患者在使用克唑替尼治疗约8个月后出现耐药。为解决这一问题,有关ALK阳性NSCLC靶向治疗的耐药机制及治疗策略已成为当今研究的热点。
色瑞替尼为第二代TKIs抑制剂,于2014年4月29日经FDA加速审批批准,临床上用于治疗ALK阳性NSCLC或经克唑替尼治疗后病情恶化及不能耐受治疗的NSCLC患者。色瑞替尼可靶向抑制ALK、胰岛素样生长因子-1R、胰岛素受体和原癌基因1酪氨酸激酶(ROS1),其中,对ALK的作用具有高度选择性。色瑞替尼的主要作用机制是抑制ALK自身以及ALK介导的下游信号蛋白的磷酸化,继而抑制ALK阳性癌细胞的增值。
据EvaluatePharma数据,2015年色瑞替尼全球销售额0.79亿美元,同比增加155%,其未来市场走势值得期待。早在2013年诺华就已向CFDA提出色瑞替尼胶囊的进口注册,且已获临床批文,目前正处于临床试验阶段(试验登记号:CTR20130873和CTR20140632)。迄今,国内已有多家企业向CFDA提出有关本品的注册申请(详见表3)。其中,石药集团中奇制药技术(石家庄)有限公司开发的原料药和胶囊已率先获得临床批件。
3.艾乐替尼
于2015年12月11日获FDA加速审批的艾乐替尼是FDA批准的第三个ALK抑制剂,临床上用于克唑替尼耐药的ALK融合基因阳性、转移性NSCLC患者的治疗。临床试验证实,艾乐替尼对于接受过克唑替尼治疗的ALK融合基因阳性的晚期NSCLC患者具有良好的疗效,尤其对于脑转移病灶局部控制率可高达83%。
据悉,罗氏正在我国开展有关本品的临床试验(临床试验登记号:CTR20150592),相信不久将会登陆中国市场,为我国ALK融合基因阳性NSCLC患者提供新的治疗方案选择。尽管目前尚未见国内企业向CFDA提出有关本品的注册申请,但估计国内企业对本品的关注度颇高。
PD-1抑制剂
Opdivo与Keytruda
黑色素瘤是临床上较常见的恶性肿瘤之一,发病率年增长率为3%~5%。黑色素瘤是一种高度恶性的皮肤肿瘤,易转移,50%~80%的晚期黑色素瘤患者会发生肝转移,8%~46%的黑色素瘤患者会发生脑转移。目前全球约有20万新发病例,死亡约6.5万例。尽管我国黑色素瘤发病率低于欧美国家,但近年发病率逐年增长,年增长率约为3%~5%,每年约有2万新发病例。
于1975年获美国FDA批准的达卡巴嗪是最早用于治疗晚期恶性黑色素瘤的药物,但达卡巴嗪单药有效率仅为7.5%~12.2%,且副作用相当大。在靶向免疫治疗药物Ycrvoy于2011年3月问世以前,达卡巴嗪成为不能手术切除恶性黑色素瘤的主要化疗药物。Ycrvoy的问世为黑色素瘤的治疗掀开了崭新一页。Keytruda和Opdivo是FDA分别于2014年9月和12月通过加快审批通道批准的PD-1抑制剂。在获FDA批准上市之前,Opdivo就已于2014年7月4日率先在日本上市,成为全球最早上市的PD-1抑制剂。Keytruda和Opdivo的问世标志着肿瘤免疫治疗时代的开始。
值得一提的是,PD-1抑制剂的出现不仅彻底改变了晚期黑色素瘤的治疗,其在NSCLC的治疗中也表现出极高的应答。FDA分别于2015年3月和10月先后批准了Opdivo作为二线药物治疗鳞状NSCLC和治疗晚期(转移性)非鳞状NSCLC(适用于经铂类药物化疗无效的肺癌患者)。此外, FDA还于2015年10月通过加速审批批准Keytruda用于治疗晚期(转移性)NSCLC,适用于其他药物治疗无效且肿瘤细胞呈PD-L1表达阳性的患者。
EvaluatePharma曾预测,2020年Pembrolizumab全球销售额将达38.79亿美元,成为颇具实力的“重磅炸弹”,而Nivolumab则有望于2020年达到60.33亿美元的销售额,成为全球最畅销的抗肿瘤品牌药。
据EvaluatePharm数据,2015年Keytruda全球销售额达5.66亿美元,同比增加929%;而Opdivo的全球销售额已高达9.42亿美元,同比增加18740%。尽管Keytruda和Opdivo均有不俗表现,但Opdivo已明显有超Keytruda之势。不过,Opdivo能否于2020年突破60亿美元的销售额值得期待。
帕尼单抗
于2006年9月27日获批的帕尼单抗是继贝伐单抗和西妥昔单抗之后获FDA批准治疗耐药转移性结肠直肠癌(mCRC)的靶向药物。帕尼单抗是一种重组人IgG2 k 单克隆抗体,用于治疗表皮生长因子受体(EGFR)表达阳性且在含氟尿嘧啶、奥沙利铂和伊立替康的化疗方案后病情仍然进展或转移性结肠直肠癌。
此外,帕尼单抗于2014年5月26日又获FDA批准新的适应症,联合FOLFOX(氟尿嘧啶/亚叶酸钙联合奥沙利铂),用于一线治疗K-ras基因野生型的mCRC。帕尼单抗从此成为首个与FOLFOX联合治疗K-ras基因野生型的mCRC具有显著生存利益的生物类药物。
本品尚未进口。Evaluate Pharma的数据显示,2015年帕尼单抗全球年销售额为7.02亿美元,同比增长4%。
依维莫司
依维莫司是一种雷帕霉素靶蛋白(mTOR)抑制剂,由诺华开发。依维莫司通过阻断细胞中PT3K-Akt-mTOR传导通道,实现了抑制肿瘤细胞生长、肿瘤细胞营养代谢及肿瘤血管生成的三重抗肿瘤作用。临床试验证实,依维莫司耐受性良好,严重不良反应发生率低。目前,依维莫司主要用于预防器官移植后的排斥反应,以及作为抗肿瘤药使用。
本品目前尚未国产化,但CFDA已于2013年6月批准飞尼妥进口中国。上市规格有2.5mg、5mg和10mg,获批适应症有:治疗舒尼替尼或索拉非尼治疗失败后晚期肾细胞癌,治疗伴有结节性硬化症(TS)的室管膜下巨细胞星形细胞瘤(SEGA),不能外科切除的进展性或转移性胰腺神经内分泌瘤(PNET)。
EvaluatePharma的数据显示,2015年依维莫司全球年销售额为19.42亿美元,同比增长22%。来自IMS的数据显示,2015年我国22城市样本医院依维莫司年销售额为1260.7万元,同比增长87.05%。可见,国内依维莫司增长迅速,未来市场可期。









 相关新闻
相关新闻