



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




近日,《仿制药质量和疗效一致性评价临床有效性试验一般考虑(征求意见稿)》挂网,而此前,为推进一致性评价工作,CFDA已数次发出相关文件含各大征求意见稿。我们看到,工作的推进需要各方面统筹协调,完善工作机制,研究解决开展过程中遇到的各种难题,特别是选择参比制剂、临床试验资源紧缺等问题,都是需要解决的。
为加快制药企业开展该项工作的进度,帮助企业解决实际难题,CFDA今年以来已在各地举办了数场培训。上月中旬,主管部门相关负责人在某重要论坛做了“药品监管创新与医药行业供给侧结构性改革”的主题报告,梳理了仿制药一致性评价相关政策,并指出:“仿制药质量和疗效一致性评价工作正转入全面评价阶段。”同时重申了开展仿制药一致性评价的目标:提升制药行业整体水平,保证公众用药安全有效;推动制药行业供给侧改革,促进产业结构调整;增强国际竞争力,促进国产药品走向世界。
截至9月12日,中检院官网公布了942个产品的参比制剂备案信息,表明230家制药公司在今年5-6月间申请或备案了参比制剂。笔者初步分析参比制剂的申请和备案情况,从中一探各制药公司的下一步规划。
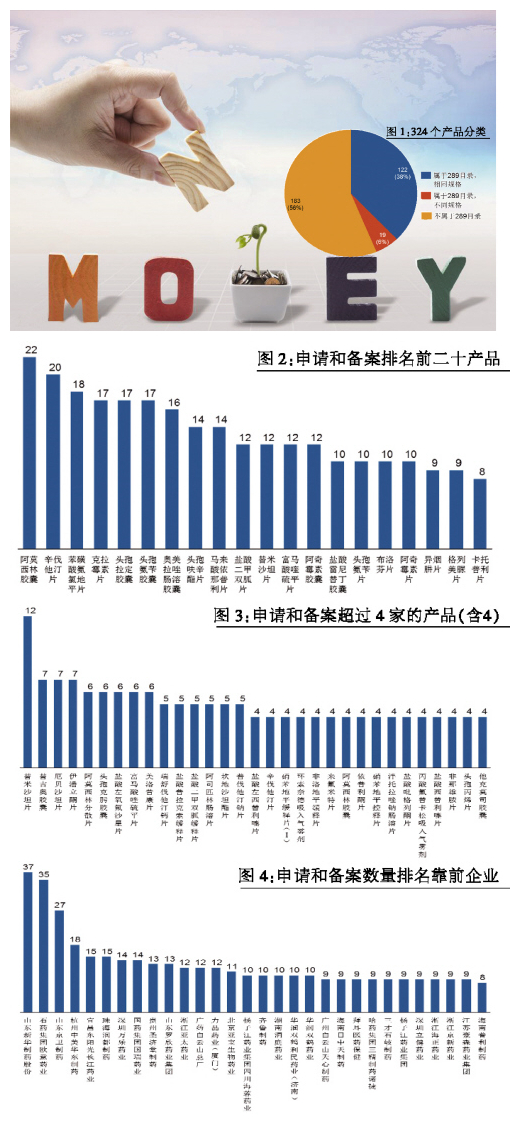
900余条申请和备案情况,涉及324个产品,属于此前公布的289个2018年前要完成一致性评价产品目录的共141个,占比达44%,其中完成相同产品规格的122个,既包含相同规格,又包含不同规格的产品为19个。值得注意的是,有183个不属于289目录的参比剂,也被申请和备案,说明相关制药企业积极响应CFDA政策号召,提前在布局(见图1)。
进一步分析具体品种,参比剂申请和备案产品的状态是比较拥挤的。前20名的产品,都有8家及以上厂家在申请和备案参比剂(见图2)。其中,阿莫西林胶囊有22个申请,排名第一;辛伐他汀片、氨氯地平片、克拉霉素片、头孢拉定胶囊、头孢氨苄胶囊和奥美拉唑胶囊等也有超过15家以上申请,竞争激烈。对于不属于289目录的参比制剂,竞争相比较稍弱一些,31个品种有4家及以上申请,其中,替米沙坦片排名靠前,有12家申请,其次是替吉奥胶囊、厄贝沙坦片、伊潘立酮片等,也有7家申请(见图3)。
进一步分析具体公司申请和备案的情况(未考虑合资公司和子公司),前30名公司都申请了8个及8个以上产品(见图4)。其中,山东新华一共申请了近40个产品,位列前茅。石药欧意、山东京卫紧随其后。
还值得关注的是齐鲁制药、江苏恒瑞、江苏豪森和浙江海正,分别申请了10个、8个、9个和9个,这些产品不属于289目录的参比剂的比例较大,反映国内制药公司在一致性评价上采用了比较明显的不同的策略。
正如主管部门相关负责人在此前会上所表示的,公布需要评价的品种目录,实际上也是为了让所有企业看看,掂量一下做还是不做,进而督促药企尽快推进仿制药一致性评价工作的进度。有消息称,主管部门接下来还可能建立季度表,及时通报同品种的评价结果,对于评价进展缓慢,可能影响市场供应的品种,会加大资金和技术引导力度,确保临床用药的可及性。如果有企业不做的,也将公布,考虑列入临床短缺目录,鼓励其他厂家仿制。
期待尽快会有下一步的公开通报,可使整个一致性评价工作更加有序地进行。
 相关新闻
相关新闻