CFDA关于征求《关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》意见的公告(2015年第231号)中,第二条明确了评价的对象和时限。对象为没有按照与原研药质量和疗效一致的原则审批的已经批准上市的仿制药,需按要求开展
一致性评价。
审评时限则分为两个部分:一是2007年10月1日前批准的国家基本药物目录(2012年版)中化学药品
仿制药口服固体制剂,应在2018年底之前完成一致性评价,届时没有通过评价的,注销药品批准文号;二是2007年以前批准上市的其他仿制药品和2007年以后批准上市的仿制药品,自首家品种通过一致性评价后,其他生产企业的相同品种在3年内仍未通过评价的,注销药品批准文号。对于后一条自首家品种通过一致性评价后的3年期限,笔者本着大胆推测小心求证的原则,认为绝大多数产品均会在2018年底这个期限内完成。
面对庞大数量的上市仿制药批文,各生产企业和CDE同样面临时间短任务重的问题。虽然因各种原因,近年来获批的化药批文数量有所减少,但由于早年存在对某些政策的误读,企业热情高涨导致批文数量不少,并且由于认识上的误差或者别的某些原因,绝大多数仿制药没有采用原研药或国际公认的同种药物作为自己产品的参比制剂。
这导致在第231号文出台后,出现了企业各种不同的表情:一些陷入急躁却无从下手,一些故作淡定观望,一些则积极投入人力物力开展相关试验力图抢得先机……无论企业表情如何,一场轰轰烈烈的一致性评价大战在即,任何人任何企业都不能置身事外。
“早年欢喜近来愁”
仿制药品种多、批文多的企业会患上选择障碍症;几年前获得大数量批文而开心的企业,成为最郁闷的企业
由于早年庞大批文数量的关系,本文仅对2007年以后批准上市的口服仿制药品情况进行分析,看看哪些企业会成为“早年欢喜近来愁”的主角,哪些品种又会成为审查频率高的主角。
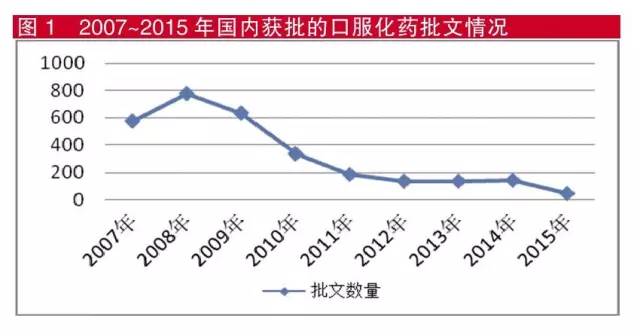
米内网药物审评数据库显示,2007年至今,获批口服化药批文数量出现前高后低的态势,高峰出现在2008年,2010年开始持续走低并保持了低迷状态,这与近年来“在审药品积压严重”的情况相吻合。
由于此次对企业开展一致性评价的鼓励政策,会通过企业最关心的医保支付、招标、采购等方式实现,谁先通过再评价的利好有可预见性,企业的行动有可能从被动变主动。那么在此项程序启动后,那些仿制药品种多、批文多的企业定会患上选择障碍症——因为在短短3年内,优先开展哪些品种哪些剂型产品的再评价工作必然成为企业的重要选题。
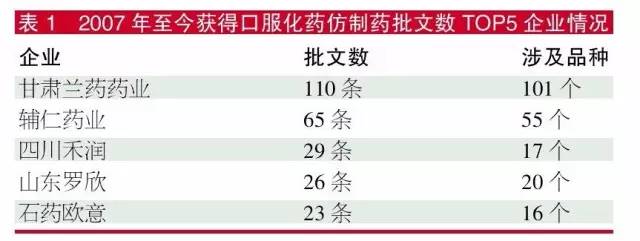
笔者对这几年获得口服化药批文的企业进行数据归纳,发现2007-2009年是个别企业获得大数量批文的年份,2010年以后企业一年内获得超过10个口服化药批文成为了稀奇事。几年前获得大数量批文而开心的企业,到今年的一致性评价时期则成为最郁闷的企业。
数据显示,虽然扬子江药业集团和国药集团等批文数量也不少,但由于分散到集团下属的各子企业,压力也分解了不少,相比表1的TOP 5企业郁闷指数会小一些。
还有,此次需要再评价的虽然只是化药6类,但其实还有为数众多的简单改剂型的5类药物,由于无需较高的技术要求,本质上也等同于仿制药。进行这部分药物的再评价工作应该只是时间问题,如果执行此类品种再评价,郁闷企业的队伍还会有所增加。
扎堆批文“后传”
时间不等人,留下能盈利有潜力的品种,同时舍弃多家拥有的非盈利品种已然提上日程
而在此段时间,有些药物的批文出现扎堆现象,固然有市场好销售旺的因素存在,也有企业因成本低廉而产生多报一个批文抢市场的心理,但这些品种却成为被重点关注的对象。
由于历史原因以及CDE对于企业申报资料只有技术审评审批权限等因素存在,只要企业进行产品注册申报而且试验资料合规,CDE就需要按程序受理并进行之后的相关技术审评审批,而不能因申报量的原因拒绝申报,由此导致一个品种出现几十上百家企业手头均握有批文的奇观。
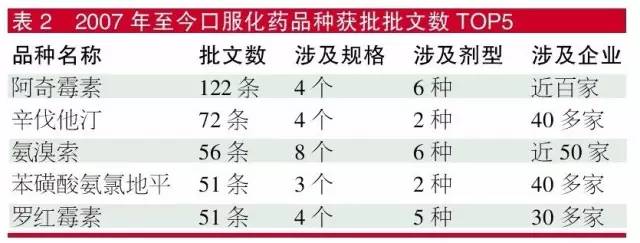
2007年至今,口服化药品种获批批文数TOP 5品种分别为阿奇霉素、辛伐他汀、氨溴索、苯磺酸氨氯地平、罗红霉素,获批批文数都超过了50个。其实,大家熟知的抗菌素左氧氟沙星,若包含盐酸、乳酸及甲磺酸3个酸根的产品,批文也有57个。而审批数据库显示,上述TOP 5产品都还有数十家的注册申请在排队等待批准生产。
对于如此多的同品种批文数以及一个企业需要进行再评价的众多品种,市场会给出什么样的反应呢?笔者推测,应该会出现一些明智企业舍弃某些批文的现象。这一推测来自注册审批品种近期撤回事件:从11月11日CFDA主动公布8家企业11个药品注册申请不予批准的消息开始,到11月26日CFDA公布90家企业撤回164个药品注册申请的公告,再到12月3日CFDA公布62家企业撤回87个药品注册申请的公告,短短不到一个月的时间,市场反应神速。
如此,那些已上市品种再评价工作政策执行的路线图已然划出。虽然还有3年时间,但是对于拥有众多品种批文的企业而言,时间不等人,下定决心留下能盈利有潜力的品种,将工作重心倾斜于它们,同时舍弃那些多家拥有的非盈利的品种已然提上了日程。












 相关新闻
相关新闻