



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2015年9月份美国FDA共审批通过9种新药,1类新分子实体药物5个;3类新剂型药物1个;4类新组合物1个;5类新规格或新生厂商药物1个;9类新药1个。
表1 2015年09月份美国FDA审批通过新药
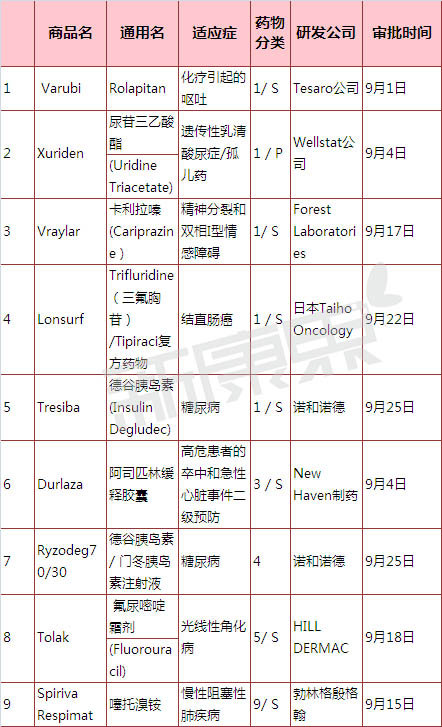
注:1)化学新药分类:1类新分子实体化合物;3类新剂型;4类新组合物; 5类药物新规格或新生产商;2)审批分类:P优先评审;S常规评审
一、化疗所致呕吐新分子实体药物Varubi(Rolapitan)
2015年09月01日,美国FDA批准了Tesaro公司的新分子实体药物Varubi(Rolapitan)上市。Varubi(Rolapitan)可与其他抗呕吐药物联合使用,用于防治癌症化疗引发的恶心呕吐的初始发作和反复发作。Varubi(Rolapitan)是神经激肽(NK-1)受体拮抗剂,NK-1受体的活化在化疗引起的恶心呕吐的过程中扮演着重要的角色,尤其是在延长期中。Varubi(Rolapitan)为片剂,每片含90mg Rolapitan,患者在化疗前1-2个小时服用180mg。由于患者服用单剂量的Varubi(Rolapitan)后,可在7天或者更长的时间内抑制药物代谢酶CYP2D6酶的作用。因此Varubi(Rolapitan)不能与经CYP2D6酶代谢的药物如硫利达嗪一起使用,以免产生严重的不良反应。
二、遗传性乳清酸尿症新分子实体药物Xuriden
2015年09月04日,美国FDA通过优先审批途径批准了Wellstat公司的新分子实体药物Xuriden(尿苷三乙酸酯)上市,用于罕见病遗传性乳清酸酸尿症的治疗。Xuriden(尿苷三乙酸酯)为尿苷替代物,尿苷可以促进体内乳清酸转变为尿苷酸,从而避免血液和尿液中大量出现乳清酸。Xuriden(尿苷三乙酸酯)为口服颗粒剂,患者开始服用时的剂量为每天60 mg/kg,当效果不佳时剂量可增加至每天120 mg/kg,但总量不能超过每天8g。
三、精神分裂和双相I型情感障碍新分子实体药物Vraylar (Cariprazine )
2015年09月17日,美国FDA批准了Forest Laboratories的新分子实体药物Vraylar (Cariprazine )上市,用于精神分裂和双相I型情感障碍的治疗。Vraylar (Cariprazine )具体的作用机理尚不明确,推测可能通激动多巴胺D2受体、五羟色胺5-HT1A受体,抑制五羟色胺5-HT2A受体而发挥作用。Vraylar (Cariprazine )为胶囊剂,共有1.5 mg、3 mg、4.5 mg 和6 mg四种规格。治疗精神分裂的推荐剂量为每天1.5mg-6 mg,治疗双相I型情感障碍的推荐剂量为每天3mg-6 mg。
四、结直肠癌新分子实体复方药物Lonsurf
2015年09月22日,美国FDA批准日本Taiho Oncology的新分子实体复方药物Lonsurf上市,用于对其他疗法(化疗及生物疗法)不再响应的难治性转移结直肠癌患者的治疗。Lonsurf由抗肿瘤核苷类似物Trifluridine(三氟胸苷)和胸苷磷酸化酶抑制剂Tipiracil组成。Lonsurf为片剂,含两种规格,分别为15 mg Trifluridine/6.14 mg Tipiracil ,20 mg Trifluridine/8.19 mg Tipiracil。
五、糖尿病新分子实体药物Tresiba(德谷胰岛素)
2015年09月25日,美国FDA批准日本T诺和诺德公司的新分子实体药物Tresiba上市,用于糖尿病的治疗。Tresiba为新一代基础胰岛素类似物,通过经皮下注射后形成多六聚体,从而发挥超长效(>24h)作用。
美国FDA审批新药主要是根据药物化学类型和治疗潜能来进行分类的。新药按化学类型主要分为:1类新分子实体化合物(NME),创新性最强。指在美国从未作为药品批准或销售的活性成分,可以是单一成分,也可以是立体异构混合物中的一部分;2类新的衍生物。从已上市的活性成分(即所谓“专利”药)化学衍生而来,即已在美国上市的活性成分的酯、盐或其它非共价键衍生物,或者是去修饰基团的母体化合物未在美国批准上市的;3类新剂型。含有已上市活性成分的新剂型或新处方,其适应症可以与上市产品相同,也可以不同;4类新组合物。含有两种或两种以上已上市的活性成分的品种,上市产品中尚无这种组合;5类药物新规格或新生产商;6类新适应症。由同一家公司或其他公司在美国批准或上市的具有新用途的复制品;7类已上市但未经NDA批准的药品。适应症已与上市产品相同,也可不同;8类变为非处方药;9类(New indication submitted as distinct NDA - consolidated with original NDA after approval); 10类适应症不同的新的新药申请。
 相关新闻
相关新闻