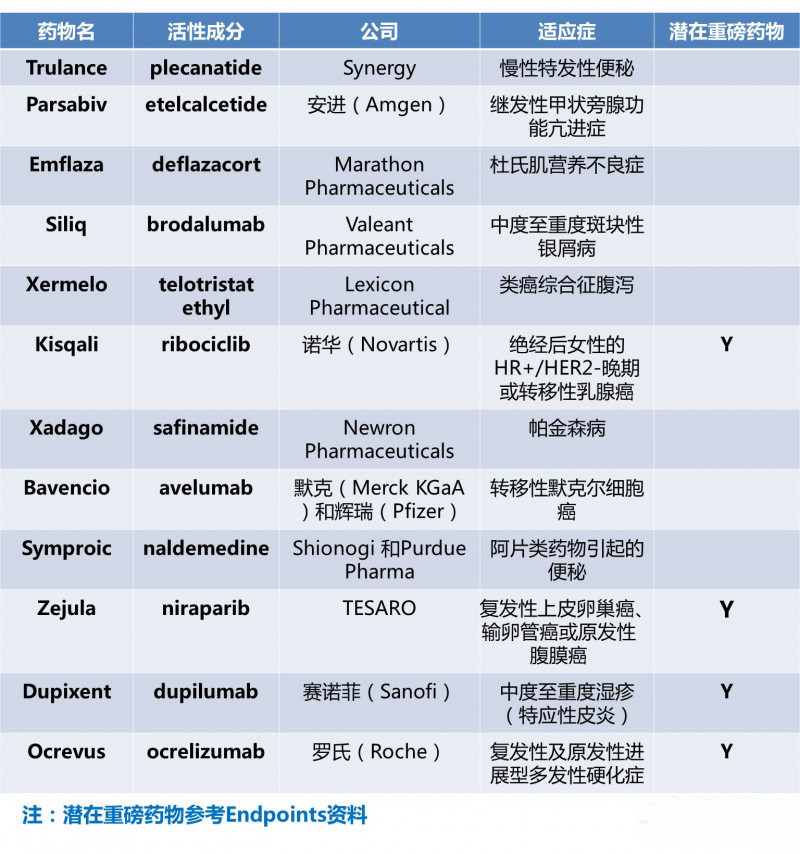
创新推动社会进步。创新药的开发就是这样,每个新疗法的问世都意味着患者有了新的治疗选择,公众健康又可能向前迈一大步。在2017年第一季度,美国FDA共批准了12种新药。与2016年第一季度的6款新药相比,足足翻了一番。今日,我们我们也对这12款新药进行总结和盘点,供大家参考。
1.Trulance(plecanatide)
开发者:Synergy公司
适应症:慢性特发性便秘(Chronic Idiopathic Constipation,CIC)
批准日期:1月19日
CIC是一种复杂的功能性胃肠道疾病,其症状包括每周少于三次的排便和不通畅的排便习惯。患者除了有腹部腹胀和不适等身体症状外,多伴有心情压力和焦虑。
Trulance是首个模拟体内尿鸟苷素蛋白(uroguanylin)功能的新型药物。尿鸟苷素为一种天然存在的内源性胃肠道蛋白肽,可以刺激流体分泌,并通过影响常规肠功能,改变粪便的稠度。
2. Parsabiv(etelcalcetide)
开发者:安进(Amgen)
适应症:继发性甲状旁腺功能亢进症(HPT)
批准日期:2月8日
继发性甲状旁腺功能亢进(HPT)是一种慢性严重疾病,影响全世界范围200多万接受透析的大部分病人,在美国就有46.8万人。继发性HPT是指甲状旁腺响应肾功能下降和矿物质代谢受损,而过度分泌甲状旁腺激素(PTH)。PTH水平升高可导致从骨组织大量流失钙和磷酸盐。由于继发性HPT通常最初不显示症状,它常常被诊断不足和治疗不足。大约88%的血液透析CKD患者会发生继发性HPT。
Parsabiv是12年来首个被批准用于治疗这种疾病的疗法,也是血液透析疗程结束时,由透析医疗护理人员每周三次静脉注射的唯一钙剂。Parsabiv是一种新颖的拟钙剂,用于治疗血液透析成人CKD病人的继发性HPT。拟钙剂是一类通过激活甲状旁腺上的钙敏感受体而模拟钙作用的药物。Parsabiv结合并激活甲状旁腺上的钙敏感受体,从而降低PTH水平。
3. Emflaza(deflazacort)
开发者:Marathon Pharmaceuticals
适应症:杜氏肌营养不良症
批准日期:2月9日
杜氏肌营养不良症是肌营养不良症最常见的类型。由于缺乏对肌纤维功能至关重要的dystrophin蛋白,患者的肌细胞无法保持完整,导致病变。据统计,全球平均每3600个新生男婴中,就有一人罹患此病。该疾病的症状通常会在三五岁时出现,并逐渐恶化。到青少年时期,患者会由于肌肉的无力或萎缩,导致行走能力逐渐丧失。到20-30多岁,患者往往会出现足以威胁生命的心脏和呼吸系统疾病症状。
Emflaza是首个经美国FDA批准,用来治疗杜氏肌营养不良症的皮质类固醇药物。在这之前,它曾获得了FDA颁发的优先审评资格、快速通道资格、以及孤儿药资格。在全球,这类激素是常见的杜氏肌营养不良症治疗手段。
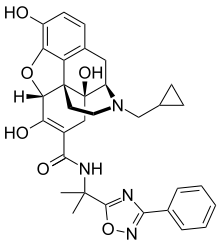
4. Siliq(brodalumab)
开发者:Valeant Pharmaceuticals
适应症:中度至重度斑块性银屑病
批准日期:2月15日
银屑病(俗称牛皮癣)是一种导致皮肤发红和剥落的皮肤疾病,而且它是一种自身免疫性疾病,在患有该疾病家族史的患者中更常见,多发病于15岁至35岁之间的人群之中。银屑病的最常见形式是斑块型银屑病,患者的主要表现为界限清楚的淡红或紫褐斑块,硬币至手掌大小,数目不定,上覆盖有细薄鳞屑。
Siliq的活性成分brodalumab是抗IL-17受体的单克隆抗体,可抑制在斑块状银屑病发展中起作用、由IL-17引起的炎症反应。
5. Xermelo(telotristat ethyl)
开发者:Lexicon Pharmaceutical
适应症:类癌综合征腹泻
批准日期:2月28日
▲Telotristat ethyl分子结构(图片来源:MedKoo)
类癌综合征是一类发生于不到10%类癌瘤患者身上的衰弱性病症,通常是在肿瘤扩散到肝脏之后出现。这些肿瘤是罕见的,并且通常缓慢生长。大多数的类癌瘤存在于胃肠道中,会分泌过量的激素血清素,可导致腹泻及多种并发症,包括体重减轻、营养不良、脱水和电解质失衡等。
Xermelo可靶向抑制类癌瘤细胞内介导过量血清素生成的色氨酸羟化酶,以降低发生腹泻的频率。Xermelo被批准可与生长抑素类似物(SSA)联用,以治疗在接受SSA疗法后病情未得到充分控制的类癌综合征腹泻患者。
6. Kisqali(ribociclib)
开发者:诺华(Novartis)
适应症:绝经后女性的HR+/HER2-晚期或转移性乳腺癌
批准日期:3月13日
▲Ribociclib的分子式(图片来源:维基百科)
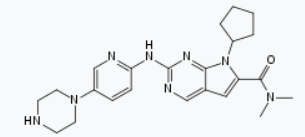
Kisqali是CDK4/6激酶的抑制剂,被FDA批准与芳香酶抑制剂联合作为初始内分泌类治疗方案,用于绝经后激素受体阳性、人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。在这之前,Kisqali已获得突破性疗法认定和优先审评资格。
7. Xadago(safinamide)
开发者:Newron Pharmaceuticals
适应症:帕金森病
批准日期:3月21日
目前,左旋多巴是治疗帕金森病最有效的药物,患者群体中服用该药物的比例高达75%。然而,长期使用这款药物可能会导致严重衰弱的运动能力波动。这种波动分为两种阶段——在“开启”期,患者的运动能力一切正常;而在“关闭”期,患者的运动能力会出现明显下降,甚至连行走都困难。因此,随着疾病的发展,这些患者需要额外的药物来应对和管理由于服用左旋多巴而产生的运动能力波动。
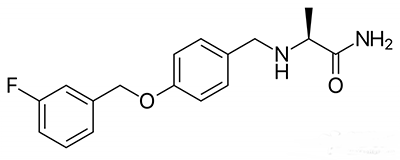
▲Safinamide分子结构(图片来源:维基百科)
Safinamide正是一款能应对“关闭”期的药物,能选择性抑制MAO-B。作为一种单胺氧化酶(monoamine oxidase),MAO-B会降解多巴胺,而多巴胺能够在脑区传递信号,对于流畅的自主运动非常重要。因此,safinamide有望能避免多巴胺被MAO-B降解。通过这一作用机制,研究人员希望safinamide能缓解帕金森病患者在“关闭”期的运动能力下降。
值得一提的是,这也是美国FDA在十多年来首个获批用于治疗帕金森病的新化学实体(New Chemical Entity)。
8. Bavencio(avelumab)
开发者:默克(Merck KGaA)和辉瑞(Pfizer)
适应症:转移性默克尔细胞癌(mMCC)
批准日期:3月23日
Bavencio(avelumab注射液,20mg/mL)可用于12岁及以上儿科和成人转移性默克尔细胞癌的治疗。这是全球首个获批治疗转移性默克尔细胞癌的抗PD-1/PD-L1免疫疗法,也是全球第二款获批的抗PD-L1单克隆抗体。之前,avelumab已获得了美国FDA的突破性药物资格、快速通道地位、孤儿药地位和优先审查资格。
9. Symproic(naldemedine)
开发者:Shionogi 和Purdue Pharma
适应症:阿片类药物引起的便秘
批准日期:3月23日
▲Naldemedine分子结构(图片来源:维基百科)
此次批准的Symproic® 0.2mg片剂C-II为一天口服一次,其活性成分naldemedine是阿片受体拮抗剂,可治疗慢性非癌性疼痛成人患者由于使用阿片类药物而引起的便秘。
10. Zejula(niraparib)
开发者:TESARO
适应症:复发性上皮卵巢癌、输卵管癌或原发性腹膜癌
批准日期:3月27日
Niraparib是一种PARP抑制剂,能阻断参与修复受损DNA的PARP酶活性。对带有BRCA基因突变的癌细胞来说,倘若PARP活性进一步受到抑制,这些细胞分裂时就会累积大量DNA损伤,导致癌细胞死亡,或是减缓肿瘤生长。
相比于其他PARP抑制剂药物,niraparib十分独特——它是首款无需检查BRCA突变或其他生物标志物的状况,就能在临床上显著改善复发性卵巢癌患者的无进展生存期的PARP抑制剂。此外,它仅需每日口服一次,就能起到控制病情的效果。因此,这是一种非常易用的维持疗法。先前,它曾获得美国FDA颁发的快速通道资格、突破性疗法认定以及优先审评资格。
11. Dupixent(dupilumab)
开发者:赛诺菲(Sanofi)
适应症:中度至重度湿疹(特应性皮炎)
批准日期:3月28日
Dupixent的活性成分dupilumab是一种人源化的单克隆抗体,被设计用于特异性抑制白细胞介素-4(IL-4)和白细胞介素-13(IL-13)的过度信号传导,这两种关键性蛋白分子被认为是特应性皮炎病理中持续性炎症的主要驱动因素。Dupilumab预装于注射器中,可以在初始加载剂量后隔周一次皮下注射自体给药。
Dupixent适用于经局部治疗仍不能充分控制的湿疹,或那些不适合使用局部治疗的病人;Dupixent可以单独使用或与局部皮质类固醇同时施用。Dupixent是首个获批针对上述适应症的靶向生物药剂。
12.Ocrevus(ocrelizumab)
开发者:罗氏(Roche)
适应症:复发性及原发性进展型多发性硬化症
批准日期:3月28日
多发性硬化症(MS)是一种中枢神经系统的慢性炎症疾病,目前尚无治愈方案。当自身免疫系统异常地攻击大脑、脊髓和视神经神经细胞周围的绝缘和支撑组织(髓鞘)时,引起炎症和随之而来的损伤,于是引发了MS。复发缓解型MS(RRMS)是该疾病的最常见形式,其特征在于患者经历一段时间的恢复期后,他们复发新的或恶化的体征或症状。大约85%的MS患者最初被诊断为RRMS。原发性进展型MS(PPMS)是MS疾病的一种衰弱形式,其症状不断恶化,虽然通常没有明显的复发或缓解期,但却是多发性硬化症中致残率最高的一类。大约有15%的MS患者被诊断为该疾病的原发性进展型形式。
Ocrevus(ocrelizumab)是一种人源化单克隆抗体,被设计用于选择性靶向CD20阳性B细胞。这一特定类型的免疫细胞被认为是造成髓磷脂(有绝缘和支持神经细胞功能)和轴突(也就是神经细胞)损伤的关键性因素;而这类神经细胞损伤可导致MS患者的残疾。基于临床前研究结果,OCREVUS结合到某些表达CD20表面蛋白的B细胞上,但不结合干细胞或浆细胞,因此也保护了免疫系统的重要功能。
参考资料:
[1] Novel Drug Approvals for 2017
[2] FDA官方网站













 相关新闻
相关新闻