



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




HIV是一种会攻击人体免疫系统的病毒,主要攻击目标是人体免疫系统中最重要的CD4T淋巴细胞,并大量破坏该细胞,使人体逐渐丧失免疫功能,从而导致人体易于感染各种疾病,甚至发生恶性肿瘤,且病死率较高。目前,全球约有3670万艾滋病病毒感染者,每年大约有110万人死于艾滋病,而新发感染者大约每年有210万。
作为G蛋白偶联因子超家族(GPCR)成员的细胞膜蛋白,趋化因子受体CCR5是HIV-1入侵机体细胞的主要辅助受体。CCR5抑制剂药物与CCR5结合后,使CCR5构象发生变化,阻断了HIV-1与细胞膜蛋白结合,导致HIV-1与CCR5在细胞表面结合的数量减少,从而起到抗感染作用。因此,CCR5可视为抗HIV-1药物的筛选靶点,值得广泛关注并进行细致研究。
关于AIDS和CCR5 的小百科
人类获得性免疫缺陷综合征(简称艾滋病,AIDS)在1981年被首次发现,25年以来,作为人类历史上最致命的流行病之一,HIV一度被认为是死刑。随着研究发展,AIDS已经成为一种可控制的疾病,但是仍无有效治愈手段。
趋化因子是一类具有趋化活性的小分子细胞因子,属于G蛋白偶联受体家族。它的功能在于使细胞表面具有跨膜G蛋白偶联受体的细胞聚集在一起,参与体内的免疫平衡作用。趋化因子受体CCR5,是人体细胞表面的一种蛋白受体。早在1996年,科学家就发现,CCR5和另一种蛋白CXCR4是艾滋病病毒HIV-1进入人体细胞的主要入点。其中,利用CCR5侵入细胞的病毒株称为R5嗜性,利用CXC4侵入的称为X4嗜性。不同的感染时期,HIV的嗜性也有变化,一般在感染初期为R5嗜性,随着感染的加深向X4嗜性转化。
CCR5是由352个氨基酸组成,在结构上分为胞外N端,3个胞外环,三个胞内环,7个跨膜α螺旋和胞内C端,其同源配体包括CCL3、CCL4和CCL3L1。CCR5是细胞内β趋化因子(RANTES、MIP1α和MIP1β)的受体,具有调控T细胞和单核细胞、巨嗜细胞的迁移、增殖与免疫的功能,主要表达在T细胞,巨噬细胞、树突状细胞、嗜酸性粒细胞、小胶质细胞和乳腺或前列腺癌细胞的族群中[1]。
CCR5在HIV侵入人体过程中扮演的角色
HIV分为HIV-1和HIV-2两种亚型,HIV-1致病力强,人类获得性免疫缺乏症(AIDS)主要是由于被HIV-1病毒感染,其能在体内快速繁殖而导致宿主免疫细胞的大量破坏所致。在 HIV-1 进入白细胞过程中,结构正常的 CCR5 蛋白质起到促进 HIV-1入胞的通道蛋白的功能。
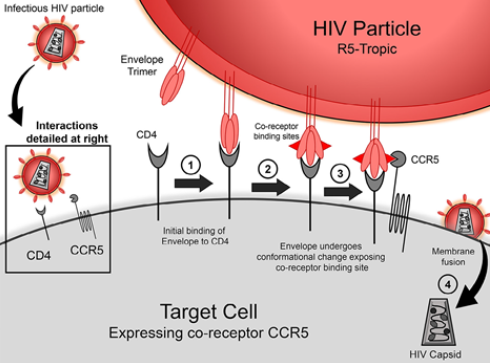
HIV-1进入靶细胞内部,导致细胞损坏死亡,从而降低机体的免疫力是一个复杂的过程:
在HIV-1侵入靶细胞时,首先会发生的是病毒表面的囊膜蛋白gp120与靶细胞表面的CD4+ T分子相互作用,致使gp120的V3可变环区暴露。
随后在趋化因子受体CCR5或CXCR4的进一步的协助下,受体N-末端的酪氨酸和其它一些酸性的氨基酸会相应的黏附到gp120蛋白暴露的V3区上,与病毒的gp120/CD4形成复合体。
接下来,病毒的跨膜蛋白gp41会发生一系列的构象变化,其自身会形成螺旋六聚体结构,促使gp41蛋白分子的N端疏水区向着胞膜方向移动,进而与靶细胞融合。
当HIV-1成功与靶细胞融合后会导致细胞死亡和被破坏,而HIV-1病毒会从细胞内出来,再次通过其他CD4+ T细胞上的CCR5受体进入其他正常的细胞。这样周而复始,就使体内CD4+ T免疫细胞的数量越来越少,机体的免疫力也逐渐下降,逐渐发展成为艾滋病,并出现很多的机会感染或生成肿瘤,从而致使人体死亡。
由于HIV-1病毒在与靶细胞结合后会使得人体的免疫力降低,使得人体有更多的可能性会感染肿瘤,因此阻断CCL5-CCR5通路会起到一定的抗肿瘤作用,其两个抗肿瘤机制分别是:
机制1:促进巨噬细胞M2亚型到M1型转换。一般在肿瘤组织周围会有很多巨噬细胞浸润,这些大量的肿瘤相关巨噬细胞(TAM)也叫M2型巨噬细胞,它们通常没有杀伤肿瘤细胞的作用,反而会释放很多趋化因子和细胞因子促进肿瘤生长和转移。当CCR5抑制剂阻断CCL5-CCR5通路后,M2型促进肿瘤生长的巨噬细胞就会转化成具有一定杀伤肿瘤细胞能力的M1型巨噬细胞。
机制2:免疫调节和改变肿瘤周围的炎性微环境。CCR5抑制剂尽管不会直接杀伤肿瘤细胞,但阻断CCR5通路后,刺激肿瘤生长的趋化因子和细胞因子都会下调,肿瘤周围的炎性微环境也会改善;同时,肿瘤周围的保护性间质会减少,表皮向间质转化能力也会下降。这种对肿瘤周围环境的影响,可以帮助免疫检查点抑制剂或化疗药物更好地杀灭肿瘤细胞。
趋化因子受体CCR5在病毒感染靶细胞过程中起到非常关键的作用,而在一些发生CCR5突变的人群中,CCR5的基因序列缺失突变,第185个氨基酸后的32个氨基酸全部缺失,这导致CCR5不能正常表达于细胞表面,从而可以阻滞HIV的侵入,使得CCR5突变的人群会对HIV病毒有免疫作用。由此可见,阻断该受体的功能是一个新颖、合理的治疗HIV手段。
已报道的CCR5抑制剂总结
病毒入侵过程是一个级联的结合与构象变化反应,根据病毒入侵复制裂解的不同阶段,拮抗剂可分为病毒入侵拮抗剂(如CD4拮抗剂、辅助受体拮抗剂)、逆转录酶拮抗剂、融合拮抗剂、整合酶拮抗剂、蛋白酶抑制剂等。目前得到美国食品与药品监督管理局(FDA)批准的抗HIV-1药物已有30多种,其中17种是逆转录酶抑制剂(包括13种核苷类逆转录酶抑制剂及4种非核苷类逆转录酶抑制剂),11种蛋白酶抑制剂,1种CCR5受体抑制剂(maraviroc),1种整合酶抑制剂(raltegravir)以及1种融合抑制剂(T20)。
虽然已经有了很多种HIV抑制剂的研发上市,但却仍未发现一种治疗艾滋病的特效药。鸡尾酒疗法,是在1996年由美籍华裔科学家何大一提出,是通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病。该疗法的应用可以减少单一用药产生的抗药性,最大限度地抑制病毒的复制,使被破坏的机体免疫功能部分甚至全部恢复,从而延缓病程进展,延长患者生命,提高生活质量。
在HIV抑制剂中,病毒入侵拮抗剂中的CCR5抑制剂受到广泛的关注。其作为抗HIV-1病毒感染的靶点,主要是基于其两方面的作用:一是通过阻断CCR5与gp120之间的相互作用阻断病毒的感染;二是通过降低或敲除靶细胞表面CCR5的表达量,进而阻断病毒的感染。以CCR5为靶点的HIV-1受体拮抗剂越来越受关注,主要有趋化因子衍生物、非肽类小分子化合物、单克隆抗体、肽类化合物等4类。目前已有几种CCR5抑制剂正处于临床前和临床试验中。
1,已上市的CCR5拮抗剂Maraviroc。Maraviroc的作用机制是能够占据病毒囊膜蛋白gp120与CCR5的结合位点,使得病毒与CCR5直接作用的机率降低,可以有效的抑制病毒与该受体的结合。Maraviroc的细胞毒性研究发现无不良影响,对CCR5具有高度选择性,在2007年8月被美国FDA批准用于临床治疗艾滋病。
2,在研临床阶段的CCR5小分子抑制剂。化学小分子抑制剂因其不具有炎症应答效应,且生产成本低等原因,在CCR5抑制剂的研究中占据了主要的地位。十几年来,在投入了大量的科研成本后,合成了几十种小分子CCR5抑制剂,其中已进入临床试验研究的有下列几个。

Maraviroc的成功,推动了CCR5抑制剂的研究进展,目前在临床Ⅱ期试验中的CCR5抑制剂Cenicriviroc,具有良好抗病毒效果。Cenicriviroc不仅可以结合CCR5,还可以抑制CCR2,使HIV感染者的免疫和代谢等功能增强。
CCR5抑制剂最新研究进展
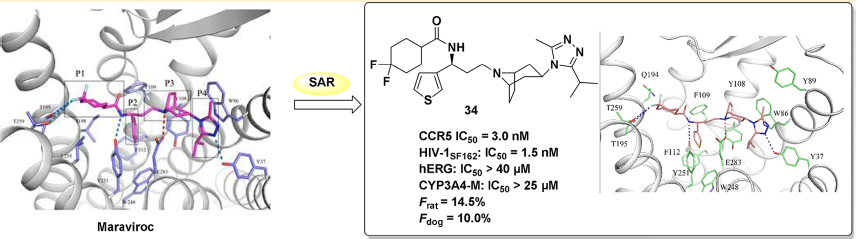
CCR5受体是一个具有较大吸引力的目标,Maraviroc是唯一已上市的CCR5抑制剂。PanfengPeng[2]等人克服maraviroc的缺点,设计、合成并测试了一个新型CCR5抑制剂--小分子化合物34,其能提高抗艾滋病效力和生物利用度。
小分子化合物34是最有活性的CCR5抑制剂,有优良的体外抑制HIV-1的活性,且其细胞毒性低,药效动力学优秀。因此,化合物34是一种有前景的能够治疗艾滋病毒感染的候选药物,值得进一步的研究和测试。
参考文献:
1, Sicoli D, JiaoX, Ju X, et al. CCR5 receptor antagonists block metastasis to bone of v-Srconcogene-transformed metastatic prostate cancer cell lines. Cancer Research.2014, 74 (23): 7103-14.
2, Panfeng Peng,Huan Chen, et al. Structure-Based Design of 1 Heteroaryl-1,3-propanediamineDerivatives as a Novel Series of CC-Chemokine Receptor 5 Antagonists. J. Med.Chem. 2018, 61, 9621-9636.
 相关新闻
相关新闻