



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药
申报受理情况:
4月份CDE共承办新的化药注册申请以受理号计728个,涉及327个品种。其中各个申请类型的具体数据如下所示:
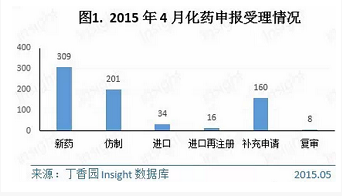
1.新药
(1)1.1类新药
8个化药1.1类新药申报临床
根据Insight数据库统计,4月份CDE共承办化药1.1类新药申请以受理号计有23个,涉及8个品种,且均为新药临床申请。具体数据如下所示:
正大天晴申报的TQ-B3234具体适应症暂时不详。这是正大天晴继2011年申报舒布替尼之后,近4年来申报的唯一一个化药1.1类新药。正大天晴是国内仿制药领域领先的医药企业,但其在创新药物研发领域仍有待加强,其目前还没有获批上市的1.1类新药。
丹诺医药申报的TNP-2092为消化道感染用药。除了TNP-2092之外,其研发管道上还有尚未申报的具有不同灭菌机理的双靶标分子新药候选物TNP-2198和TNP-2500。
萘福帕罗,是山东亨利继阿莫奎尼之后申报的第2个1.1类新药。根据山东亨利现有的产品线研发进展推测该药即为KBP-7026,为选择性的趋化因子受体(CRTh2)抑制剂,用于治疗炎症和自身免疫性疾病,如哮喘和慢性阻塞性肺病。
罗氏申报的RO6889678,为咪达唑仑同类药物,催眠镇静药。江苏豪森申报的HS-10241为c-Met抑制剂,抗肿瘤新药。
倍他替尼,为EGFR抑制剂,用于治疗非小细胞肺癌。该药是由精华制药以出资1000万元及未来销售提成的方式从Aspedia公司购得其国内及港澳地区独占的专利使用权。
阿斯利康申报的AZD3759,用于治疗非小细胞肺癌。歌礼生物科技申报的ASC16为NS5A抑制剂,丙肝治疗药物。
(2)3.1类新药
齐鲁制药抢仿迅速,糖尿病热门新药曲格列汀遭国内药企争相仿制
4月份CDE共承办新的化药3.1类新药申请以受理号计有210个。其中临床申请有195个,涉及65个品种;上市申请15个,涉及12个品种。
维莫德吉(Vismodegib),由罗氏子公司基因泰克研发,于2012年1月获得美国FDA批准上市,用于治疗成人最常见的皮肤癌——基底细胞癌。这也是FDA批准的首个治疗转移性基底细胞癌的药物。
贝洛替康(Belotecan),为喜树碱类抗癌药物,由韩国钟根堂制药公司研发,2004年在韩国首次上市,用于治疗小细胞肺癌和卵巢癌。
卡非佐米(Carfilzomib),由安进子公司Onyx公司研发,2012年7月获得美国FDA批准上市,用于至少接受过两种其它药物治疗后疾病出现恶化的多发性骨髓瘤患者的治疗。石药集团是国产厂家中首次申报,但在此之前安进已申报进口。
帕布昔利布(Palbociclib),是一种选择性CDK4/6抑制剂。今年2月份刚获得美国FDA批准上市,商品名为Ibrance,用于治疗绝经后妇女的晚期/转移性乳腺癌。这也是目前首个获得FDA批准的CDK4/6抑制剂。辉瑞于2013年5月在国内申报进口新药临床,2014年7月获批临床,目前处于临床试验阶段。齐鲁制药是国内首个申报的国产厂家。
曲格列汀,是一种超长效DPP-4抑制剂,武田制药于今年3月份刚在日本获批上市,商品名为Zafatek。它是全球首个已上市的每周仅需口服一次的降糖药,无疑将为糖尿病患者提供更为方便的治疗选择。齐鲁制药是国内首个申报该药的厂家,抢仿迅速。截至目前,重庆医工院、东阳光也已紧随齐鲁之后提交了该药的注册申请,竞争亦是相当激烈。
2.仿制
仿制药申报情况相对稳定
4月份,CDE共承办化药仿制药新申请以受理号计有201个,涉及111个品种,116家企业(未合并同集团下子公司),数量上与3月份近乎持平。这些品种主要集中在消化道及代谢用药、神经系统、抗感染用药、心血管系统等治疗领域。
3.进口
GSK提交多替拉韦进口上市申请
4月份CDE共承办新的化药进口注册申请以受理号计有34个,共涉及28个品种。其中,临床申请有17个品种,上市申请有11个品种。其中,葛兰素史克的多替拉韦(Dolutegravir)为国内首次上市申请。
多替拉韦,由葛兰素史克旗下ViiV公司研发,分别于2013年8月和2014年1月在美国和欧洲获批上市,商品名为Tivicay。它是全球继默沙东的拉替拉韦之后已上市的第二个HIV整合酶抑制剂。
另外,多替拉韦拉米夫定阿巴卡韦的三合一HIV药物,也分别于2014年8月和9月在美国和欧盟获批上市,商品名为triumeq。
审批情况:
6个化药
1.1类新药获得临床批件
根据Insight数据库统计,4月份共有6个化药1.1类新药获得临床批件,江苏恒瑞、江苏豪森、江苏恩华等企业均有斩获。
二、中药
4月份CDE共承办中药新申请以受理号计有39个,数量上与往期近乎持平。其中新药申请11个,补充申请27个,复审1个。
三、生物制品
4月份CDE共承办生物制品新申请以受理号计有69个。
其中1类新药有2个品种,均为临床申请。分别是北京天坛生物的H7N9流感病毒裂解疫苗、信达生物制药的重组人血管内皮生长因子受体-抗体-人补体受体1融合蛋白注射液。
来源:医药网