2017年FDA批准的首仿药大盘点
前言
首仿药(First generics),是指FDA首次批准允许上市的仿制药。FDA考虑到首仿药对公众健康具有重要意义,因此,一般会对首仿药进行优先审评。另外,为了鼓励制药企业积极研发首仿药,《药品价格竞争和专利期恢复法》(又称“Hatch-Waxman法案”),规定第一个向FDA递交ANDA,并含有paragraph IV certification,即证明未侵犯专利权或专利无效证明,如果专利挑战成功,FDA将授予180天的市场独占期。
知识链接
FDA提出ANDA申请市场独占期的具体规定:
(1)只有第一个提出完整ANDA申请和paragraph IV certification(PIV)的申请者给予180天市场独占期;
(2)FDA对未受到专利所有者或NDA申请人起诉的第一个ANDA申请者给予180天市场独占期;
(3)如果多个申请人同一天提出ANDA申请,都可以获得180天市场独占期;
(4)药品的每个规格分别给予市场独占期;
(5)2003年《处方药与医疗保险促进法》(Prescription Drug and Medicare Improvement Act)规定了5种丧失180天独占期的情况,包括第一个申请人未能在规定时间内上市;第一个申请人撤消申请、补充申请或撤回不侵权证明(PIV);在一段规定时间内未获得暂时性批准;违反《反托拉斯法》(Anti-trust laws)的协议;专利不侵权证明中列入的专利全部过期[1]。”
截止8月2日,2017年FDA共批准了46个首仿药。其中有17个仿制药成功通过专利挑战,获得180天的市场独占期。
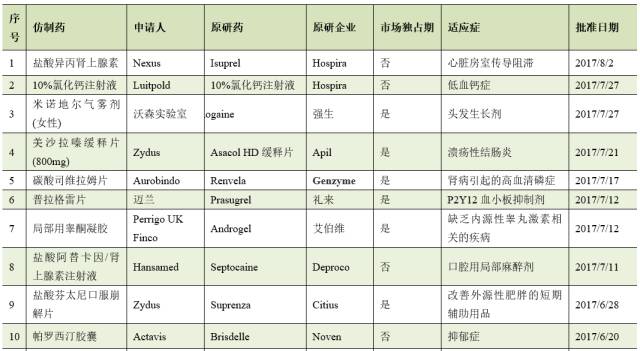
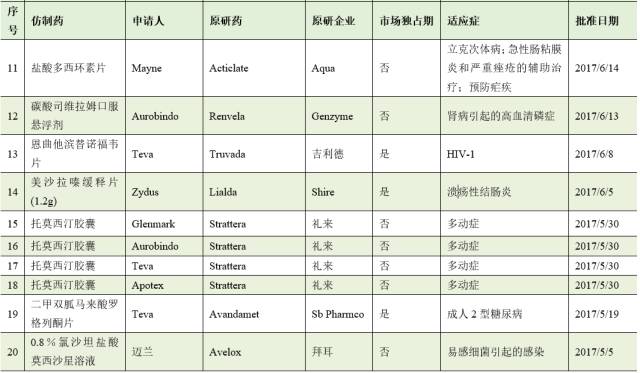
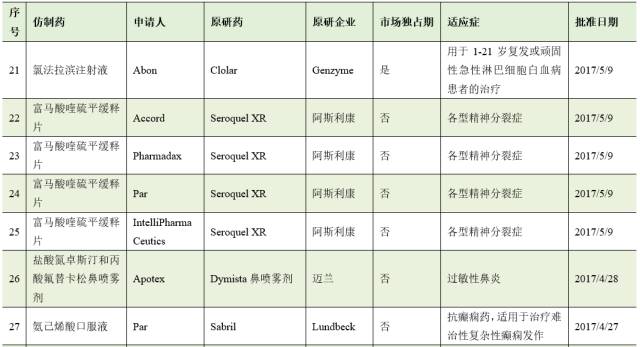
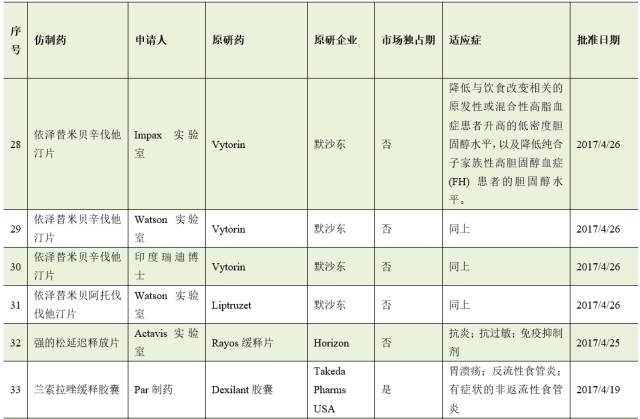
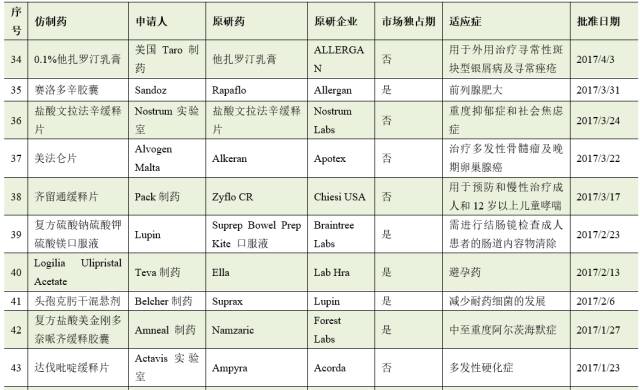
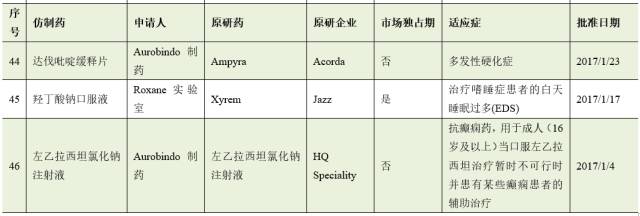
仿制药企业通过专利挑战并取得美国首仿药资格上市,不仅仅可为企业赢得巨额利润,也通过技术和资金的积累,为企业下一步新药研发创新提供重要的支撑与保障。因此,在当今医药市场多方博弈的竞争格局中,我国医药企业在美国提交ANDA申请,开展仿制药专利挑战,争取180天独占期,获得与跨国药业巨头竞争的主动权。
2017年8月21日,华海药业的帕罗西汀胶囊正式获得ANDA文号(207188)。这是国内第一个PIV专利挑战成功的仿制药。此次,帕罗西汀胶囊批准的适应症为治疗与绝经相关的中度至重度血管舒缩症状(VMS)。帕罗西汀胶囊由Noven研发,于2013年被FDA批准在美国上市。当前,美国境内仅有专利产品在市场上销售。该产品亦未在国内上市。2016年帕罗西汀胶囊美国市场销售额约2500 万美元[2]。
此次,帕罗西汀胶囊获得美国 FDA 批准文号标志着华海药业在首仿药和挑战专利产品领域的业务稳步推进,同时能够有效提升公司的核心竞争力。
参考文献:
[1] 董丽,杨悦.美国药品专利期延长与市场独占期规定研究[J].中国医药导刊,2006,(05):391-392+384.
[1] 华海药业.浙江华海药业股份有限公司关于制剂产品帕罗西汀胶囊获得美国FDA批准文号的公告[EB/OL]. [2017-08-27].

分享到:














 相关新闻
相关新闻