FDA新药审评显著提速
2016年是新药上市低谷的一年,但FDA至少出现了一个令人鼓舞的趋势:审批时间明显快于上一年。
近年来美国加速新药审批过程的努力获得了预期的效果,鉴于特朗普任期内的FDA新局长候选人也主张改革药物审批过程,新药审批将继续提速。
常规审评加速明显
去年,CDER和CBER共批准了25种新药,为近十年最少,但FDA认为这是自然波动的结果。例如,按照美国《处方药申请者付费法案》,有5个新药申请的审评截止日期本来是2016年,但在2015年就被提前批准了,而审评截止日期落在2016年的新药申请本身也比较少;此外,2016年FDA给新药申请发出完整答复函的数量也明显增加。
据悉,CDER(负责小分子和某些抗体药物审批的部门)收到了36份新分子实体(NME)的上市申请,略高于过去十年每年申请的平均数(35个)。
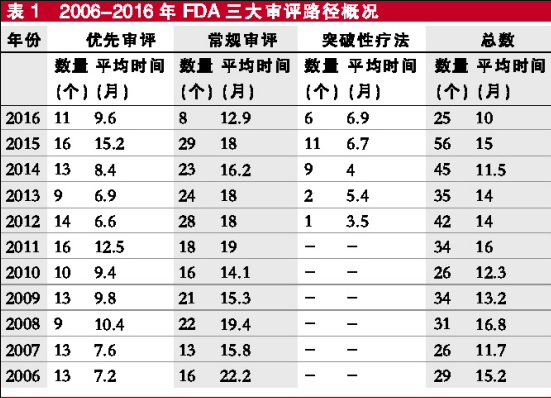
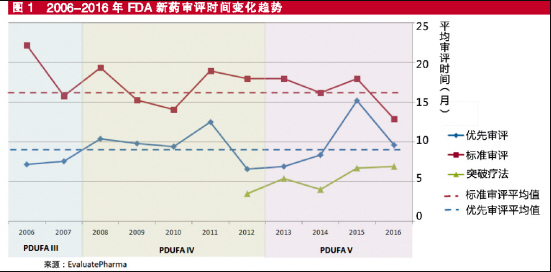
EPVantage按照FDA优先审评、常规审评与突破性疗法3种路径分类,对过去10年NME平均获批时间进行了梳理。从数据分析看,去年审评速度的整体改善是由于常规审评的速度大大提高。优先审评的速度和过去10年的平均速度相当,而突破性疗法的审评速度似乎已经放缓。
不过,突破性疗法的申请数量相对较少,考虑到该路径推出时间还不够久,要从时间趋势数据中得出任何有意义的结论可能还太早。
然而,新药审批的平均时长每年都有很大变化,因此,想要从这一分析中得出任何具体的结论并不容易。例如2015年,获批上市的新药数量庞大,而审批时间却大大延长。
值得关注的是,2016年的新药上市申请没有出现时间被明显延长的情况,否则新药获批数据会更加难看。
FDA继续承压
过去10年,美国《处方药申请者付费法案》经历了3次修改,从平均水平来看,新药审评时间的缩短趋势显而易见,特别是常规的新药审评路径。
目前的《处方药申请者付费法案》将于今年9月到期,在新药审评方面,第6版《处方药申请者付费法案》或许会包含提高该过程灵活性的措施。提案中包括建议FDA和申请人在新药申请审评期间正式签署一个互相交流的方案。
FDA新局长尚未任命,没有人希望FDA发生影响新药审评效率的重大变化。由于第6版《处方药申请者付费法案》的大部分框架已获批准,新局长不大可能对这项立法产生很大影响。即使有改变,预计也会使政策更加宽松。
事实上,不管谁最终被任命为新的FDA主管,FDA都面临着缩短新药审评时间的压力。

分享到:










 相关新闻
相关新闻