一致性评价"卡位战"谁已抢得先机?
9月5日,CFDA正式发布《仿制药质量和疗效一致性评价受理审查指南》,仿制药一致性评价申报资料接收/受理部门由省局改为总局受理和举报中心。据CFDA药审中心副主任周思源介绍,9月8日,CFDA正式开始受理仿制药疗效与质量一致性评价工作,截止10月11日,CFDA受理并已移交至药审中心的一致性评价申请共计12件,分别来自9家企业提交的10个品种12个品规。当2018年底大限日益临近,这场事关生死的一致性评价“卡位战”,哪些企业已经抢得先机,让我们一起来看一看。
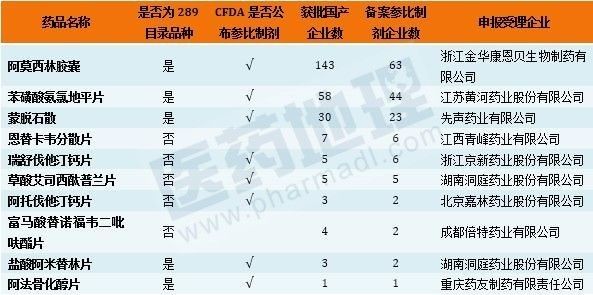
数据显示,受理品种中289目录品种和非289目录品种均为5个,各占一半比例(表1)。在289目录品种中,前期参比制剂备案和BE临床试验备案最集中的品种阿莫西林胶囊和苯磺酸氨氯地平片赫然在列,在众多的竞争者中浙江金华康恩贝生物制药有限公司和江苏黄河药业股份有限公司领先一步,率先完成产品一致性评价研究进入申报阶段。从样本医院药品采购数据来看,这两家企业在所申报品种近年的销售排名中均处相当靠后的位置。借助仿制药一致性评价的契机,两家企业通过快速推进一致性评价工作,抢占头三家通过一致性评价的位置,以便在市场全新洗牌的过程中实现弯道超车的意图相当明显。
类似情况的还有湖南洞庭药业股份有限公司率先申报草酸艾司西酞普兰片一致性评价,数据显示该品种获批生产企业并不多,共5家。样本医院购药数据显示,湖南洞庭药业股份有限公司产品销售落后其他企业。艾司西酞普兰近年市场销售金额增长迅速,5家生产企业均早早地完成了参比制剂备案,其中3家进行了BE临床试验备案,湖南洞庭药业股份有限公司BE试验公示时间不是最早,但貌似进展最为顺利,如能率先通过审评,市场格局或将重构。
表1. CFDA受理并已移交至药审中心的一致性评价申请情况(截至10月11日)
数据来源:中国新药研发监测数据库(CPM)
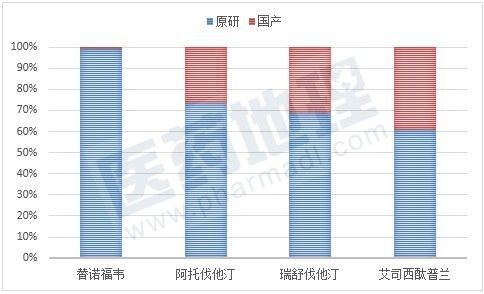
获受理的这些非289目录品种预计将同样面临着市场格局的重塑,目前这些品种拥有批文的国内企业并不多,由此带来的市场竞争应该不算太激烈,但国内市场绝大部分份额由原研药占据,国产仿制药市场空间受到很大挤压(图1)。国内企业抢在第一时间推进仿制药一致性评价工作,一旦获得通过,原研药原有的质量优势不再,外资企业独大的现状或将改变。
图1. 部分品种原研药与国产药2016年样本医院采购金额占比

分享到:








 相关新闻
相关新闻