集中审评3.0——药品价值评估的重构
近日,在美国“癌症登月计划”的框架下,FDA进行了一项组织架构方面的创新改革,将抗肿瘤相关的所有药物、疫苗、体细胞治疗、医疗器械的临床审评统归至一个新组建的“肿瘤卓越研究中心(Oncology Center of Excellence)”下。而按照之前FDA的审评机构设置,化药、单抗等归为药物,由药品评价和研究中心(CDER)审评管理;肿瘤疫苗和体细胞疗法则归属生物制品评价和研究中心(CBER)管理,分别对应于下辖的疫苗研究和审评办公室,以及细胞、组织和基因治疗办公室;抗肿瘤药物常用的伴随诊断试剂则由器械和辐射健康中心(CDRH)管理。
集中审评是药品技术监管的自然延伸
简单地看,药品审评机构是医药产品的考场,只有合格通过才可以顺利毕业。由于大众认为,药品审评这项活动是对一款产品的约束性考量,本身并不像研发、商业推广那样创造明显的附加价值,因此往往希望监管机构的审评不要成为阻碍药品上市的限速步骤。但人们只理解漫长的研发数据积累,却要求监管方短暂的惊鸿一瞥,这显然是不公平的。而由于研发过程太艰难、不确定性太高,人们尽管在不断地探索提高研发效率的模式,也还需要其他努力来加速药品的上市进程。因此,提高监管机构的审评效率成为一条相对具有可操作性的途径。
当前美国、日本、澳大利亚、中国等国家都是按照产品的技术特性来进行监管分类,例如对化药、生物制品、器械等等进行划分。这符合人们的认知,也便于根据不同类型的产品采取相应的技术要求。生物制品相对化药更注重全程控制,并且免疫安全性等问题是重要考量,而器械不参与人体代谢,这与药品有本质区别,注重的质量属性也会有所差别。因此不难理解,通过产品特性划分实现这种最初级的集中审评能够整合各专业背景的审评人员,提高审评效率。
第二种集中审评不知是否为中国特有。在二十一世纪初,药品新政实施、药企基数大、资本流入、申报门槛低等多因素共同作用下,中国药品审评一直存在排队积压的顽疾。历史上,中国药监机构曾采取同品种集中审评的方式来提高审评效率,自去年起的临床试验数据核查等配套措施更是将这一手段的效果发挥到极致。由于同品种重复申报严重,将相同药品品种集合审评,能够进一步集约化地利用有限的监管资源,并且通过直接的横向检阅,更有利于将政策资源向真正高质量的药品倾斜。
按疾病领域建立审评单元,加快审评速度
FDA此次将癌症这一疾病领域作为审评资源配置的结构单元,非常本质地体现出按照对疾病的获益来分配审评资源的政策趋势。与中国式被动的同品种集中审评不同,这是一次按疾病领域集中审评的主动尝试。肿瘤是一种复杂的疾病,近年来人们在这一领域正沿着不同的方向去发现对病人创造临床价值的手段,各种各样的新产品正处于爆发性增长的阶段。FDA此前已在内部建立一些机制来加强审评部门之间对肿瘤领域相关问题的交流,包括跨部门的月度会议、合作研究和出版论文等等。“癌症登月计划”拨出10亿美元用于美国NCI和FDA的癌症研究,则成为这次FDA肿瘤审评架构调整的直接原因。
FDA建立的肿瘤审评中心主要针对临床方面,能够集中药品、细胞治疗、疫苗、器械等各路专家,在临床获益方面对日益复杂的抗肿瘤产品提供综合的评价,但保持了产品质量控制、工艺等方面审评的独立性。例如带有伴随诊断试剂的抗肿瘤药为药械组合产品,目前的流程是诊断试剂由器械中心审评管理,药物归属药品中心,如果将两方面的专家集中起来,势必将压缩审评的时间。又例如安进的IMLYGIC是FDA批准的第一个治疗性抗肿瘤疫苗,审评经验相对匮乏,在最初的审评中建议根据产品的持续缓解率(DRR)纳入加速批准途径(Accelerated Approval)。但抗肿瘤药加速批准的一般模式是根据缓解率等替代终点获批,上市后进一步验证生存期等疗效终点,而IMLYGIC已显示对总生存期不存在改善效果,那么上市后的验证研究就成了一个伪命题。并且,作为直接在黑色素瘤局部给药的产品,无法开展与其他常规安慰剂或对照药的比对试验,与其他药物联用也无法体现该药的单独治疗获益,因此FDA的临床审评最终将该药物确定为常规批准(Traditional Approval)。设想如果在一个肿瘤审评中心集合临床、法规等方面的专家,并通过一套有效的机制进行集中审评,将有可能缩短对IMLYGIC这种创新产品的评价时间。通过整合临床审评资源,企业真正有价值的抗肿瘤产品能够更快地获批,病人能够更快享受到最新的治疗手段。时代的大潮是鼓励真正对疾病产生获益的产品,按照疾病领域来构建审评资源可以说是对这一潮流的政策强化。但如何从机制上设计一套适用于各种抗肿瘤产品的审评流程,使这种基于疾病领域构建的审评单元既不流于表面,又能够保持与各产品质量评估的无缝衔接,是对监管艺术的极大挑战。
新审评模式是药品价值评估的重构
目前尚不知道“肿瘤卓越研究中心”具体如何运营,但按照美国“癌症登月计划”的意图,它目的是整合所有可用的各类资源,引导投资方向,对癌症控制提供真正的获益。笔者认为,在医药产品的生命周期中,外部市场对产品有三次主要的价值评估,即资本的评估、监管机构的评估和支付方的评估,而监管机构的评估是承接前后二者的核心所在。监管机构对于某疾病领域医药产品的价值梳理,能够在一定程度上使医药研发创新生态体系的内部协调发展,也为Chorus等“大研发”模式和福布斯专栏作家Matthew Herper提出的“大支付”模式提供了强有力的辅助。
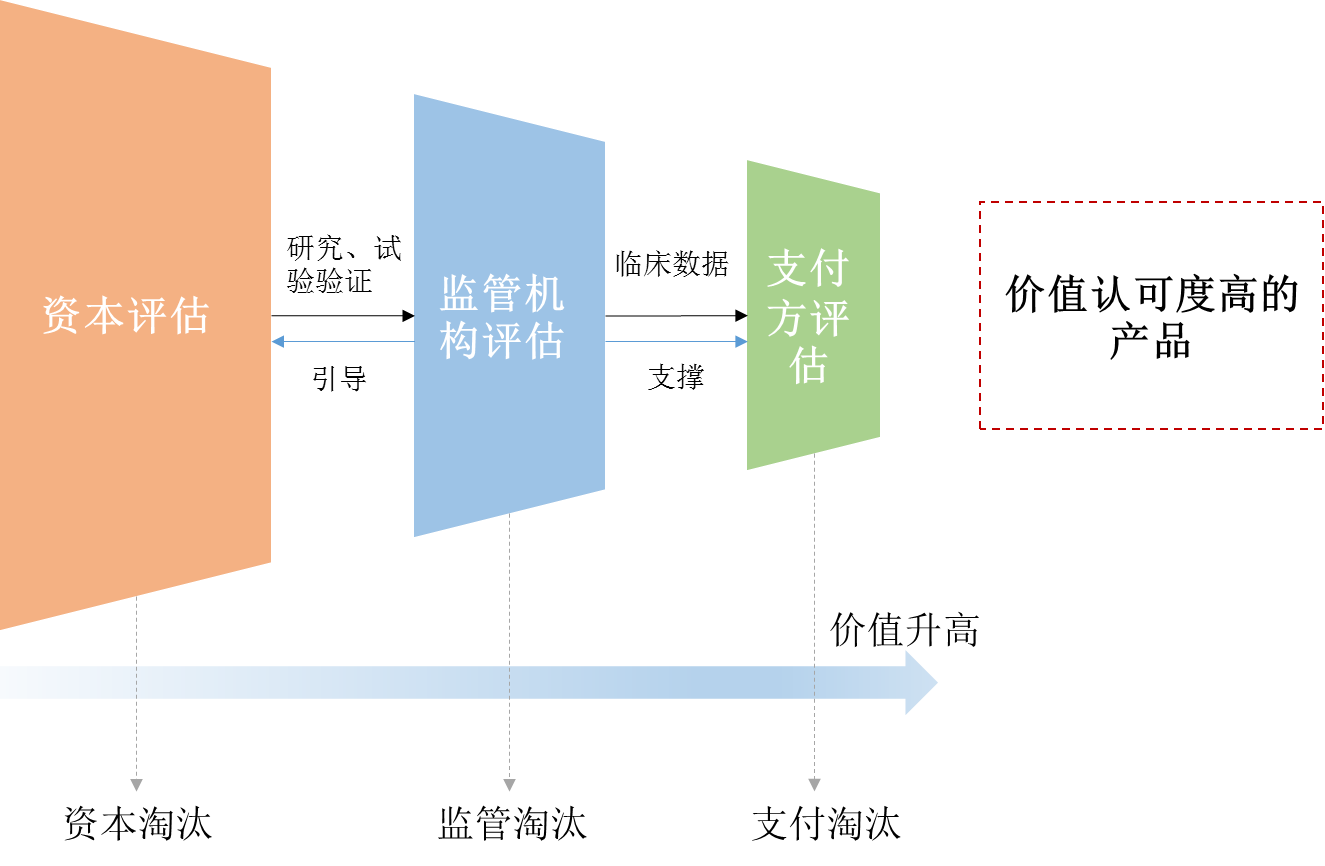
沿着价值评估的链条,未来能够获得更多政策资源、产生更多经济效益的必将是具有高品质研发实力的“发动机”型企业和有助于产品通过价值评估考验的“链条”型企业。前者包括具备资源整合能力的规模化药企巨头、具备创新突破能力的小型生物技术公司等,后者为优质CRO、原辅料供应商、经营商等。但癌症领域的产品丰富,精准医疗的概念和各种有效的治疗手段已为人们开启了前进的道路,进而才借着政策的顺风催生出“肿瘤卓越研究中心”这一产物,该模式对于其他疾病是否适用,还有待商榷。

分享到:









 相关新闻
相关新闻