



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




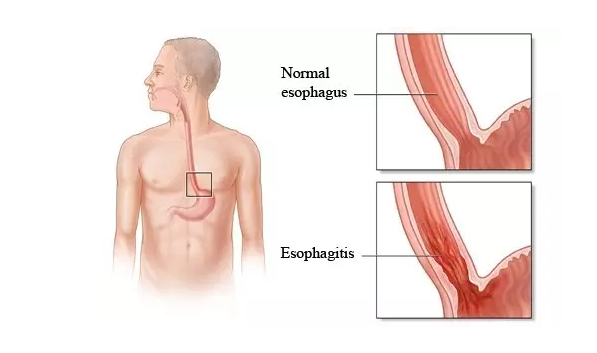
EoE是一种慢性罕见疾病,由于嗜酸粒细胞侵润食管上皮引起食管功能异常,表现出吞咽困难、食物嵌顿和呕吐等食管功能障碍的症状。据统计,在西方国家中,每10万人中约有15~55人会受这种疾病影响。SHP621是Shire公司研发的哮喘类固醇budesonide口服混悬剂。基于一项II期数据显示,SHP621 的12周治疗方案可显著缓解青少年和成年EoE患者的吞咽困难症状。
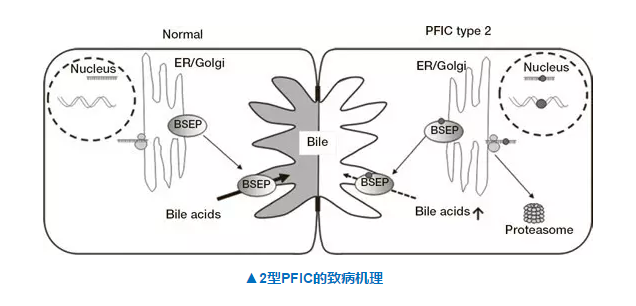
PFIC是一组通常在婴幼儿期间起病的常染色体隐性遗传疾病,患者胆汁排泌有障碍,以肝内胆汁淤积为主要临床表现,最终还会发展为肝衰竭。2型PFIC源于编码胆盐排泄泵(bilesalt export pump,BSEP)蛋白的基因ABCBI1突变。SHP625是Shire公司研发的一个顶端钠依赖性胆汁酸转运体蛋白(ASBT)的抑制剂,能有效阻止胆汁酸在回肠的重吸收和增加粪便胆汁酸的排泄。 Shire的SHP625正在被发展成为一种儿科口服治疗方案,其II期临床研究的中期结果表现良好。
 相关新闻
相关新闻