去年FDA批准新药在国内注册情况如何?
FDA批准的新药向来都是国内医药研发者关注的焦点,了解这些新药的具体信息是制药企业必不可少的一门功课。
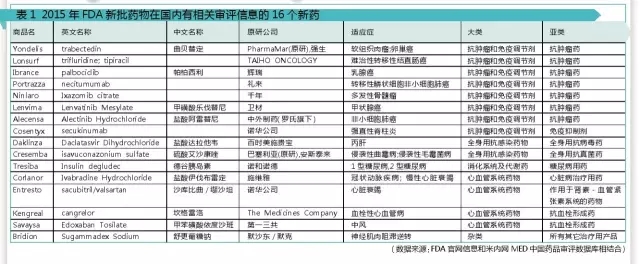
2015年FDA共批准了45个新药,包括33个新分子实体(NME)和12个生物制品许可申请(BLA)。据米内网MED中国药品审评数据库统计,这45个新药中有16个新药在国内药审中心有相关的注册审评情况,包含化药申请13个,治疗用生物制品申请3个。
抗肿瘤药占7席
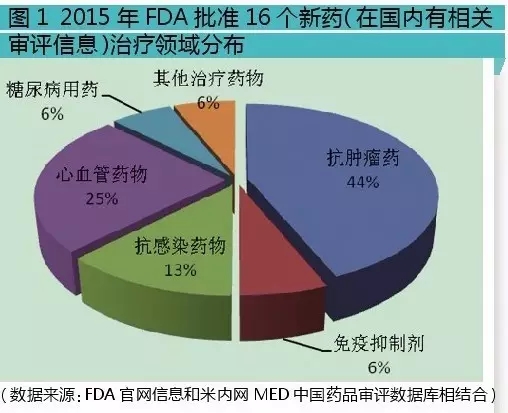
这16个新药中,按治疗领域分:抗肿瘤药与免疫抑制剂有8个,7个为抗肿瘤药,1个为免疫抑制剂;全身用抗感染药有2个,其中抗病毒药、抗真菌药各1个;消化系统及代谢药1个,为糖尿病用药;心血管系统药有4个,其中2个为抗血栓形成药,心脏病治疗用药和作用于肾素-血管紧张素系统的药物各1个;其它治疗用产品1个,用于治疗神经肌肉阻滞逆转。
从以上分析可知,抗肿瘤、心血管、抗感染药物占比是最大的3个板块,这3个领域也是近年的研发热点。
国内审评最新进展
1只有原研公司申请的7个新药
据米内网MED中国药品审评数据库统计,上述16个新药中的7个只有相应的原研公司注册审评情况。
值得注意的是,Tresiba(德谷胰岛素注射液)已于2012年9月28日获得日本医药品医疗器械综合机构(PMDA)批准,2013年1月21日获得欧洲药物管理局(EMA)批准,2015年9月25日获得美国FDA批准上市。目前该药在中国处于在审评阶段,申请类型为上市申请,若一切顺利的话,预计2017年就能在中国上市。
处于批准临床阶段的3个新药是:Alectinib胶囊、Daclatasvir Dihydrochloride片、Necitumumab,还需要等待相对漫长的审评时间。
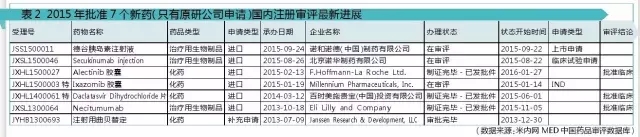
2存在国内仿制情况的9个新药
从图2可以明显看出,Ibrance、Corlanor、Entresto这3个品种受到诸多国内药物研发者的青睐,分别有11家、18家、14家国内企业进行了研发仿制。
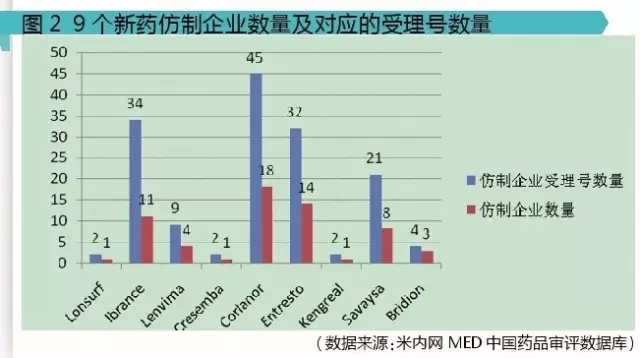
其中,仿制企业最多的品种是Corlanor:盐酸伊伐布雷定片,原研公司:施维雅,已于2015年4月29号在我国批准上市。
被业界纷纷看好的抗心衰药物诺华的Entresto(sacubitril/valsartan复合剂,沙库比曲缬沙坦片)也有诸多国内企业进行了仿制,多达14家。业内普遍预计,2020年Entresto全球销售额将会达到40亿美元以上。
辉瑞的抗肿瘤新药Ibrance:Palbociclib,帕柏西利胶囊,于2015年2月3日在FDA批准上市,2015年全球销售额就高达7.23亿美元,预计销售额峰值能达到30亿美元以上。
由于庞大的市场需求,Entresto和Ibrance受到国内企业的追捧也在意料之中。
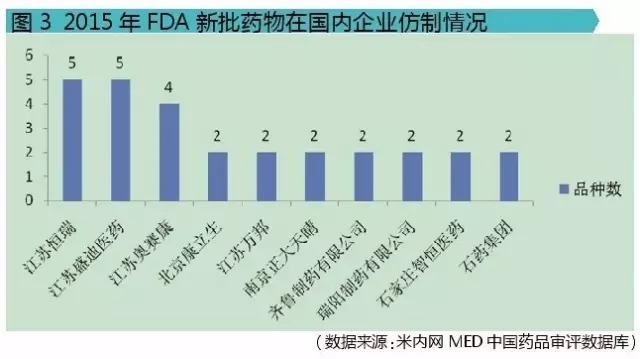
经过对这9个新药的相关审评信息分析,可以看出国内企业的研发实力。江苏恒瑞医药股份有限公司、江苏盛迪医药有限公司、江苏奥赛康药业股份有限公司3家公司的仿制品种数排在前列,分别是5个、5个和4个。此外,北京康立生、江苏万邦、南京正大天晴、齐鲁制药、瑞阳制药、石家庄智恒医药、石药集团均有2个仿制品种,其余30家国内企业均各有1个仿制品种(不纳入图表中分析)。虽然这只是特指对2015年FDA新批药物的仿制,只是比较小的一个层面,但也能间接看出排在前三公司的研发实力。

分享到:









 相关新闻
相关新闻