年终盘点近年来FDA新药批准概况
截止到2016年12月9日,FDA全年共接收到了36个新分子实体(NEM)的申请,与过去10年的平均水平基本相符合。十几年来,FDA虽然批准率逐年递升,但其工作量和效率仍然变化不大。看看下面这些概况分析,也许你能找到顺利FDA新药批准的最佳时机。
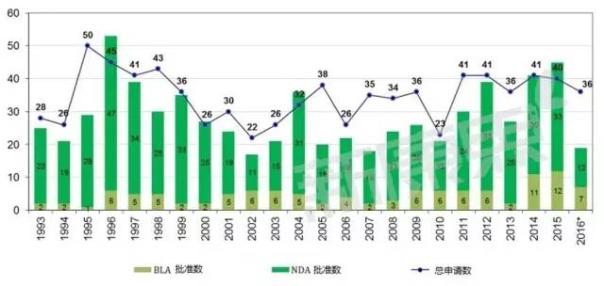
新分子实体批准情况
NME(New Molecular Entity )
新分子实体包括两类:一类是NDA(new drug approval)即新药上市许可申请,另一类是biologicslicense application (BLA)即生物制品上市许可申请。
从1994年到2016年12月FDA接受到的申请和批准情况如下图所示:
截止到2016年12月9日,FDA全年共接收到了36个新分子实体(NEM)的申请,与过去10年的平均水平基本相符合(平均数为35),其中有19个新分子实体被批准,包括12种新药上市许可(NDA)和7种生物制品许可(BLA)。这19种药物中又包括了7种孤儿药,2016年的批准数目与2015年相比有较大的下滑,2015年共被批准45种新药,其原因包括以下几个方面:有5种NME计划2016年批准,被提前到2015年;2016年申请的数目相对较少; 2016年发布的全项审评意见函(CR)较多。
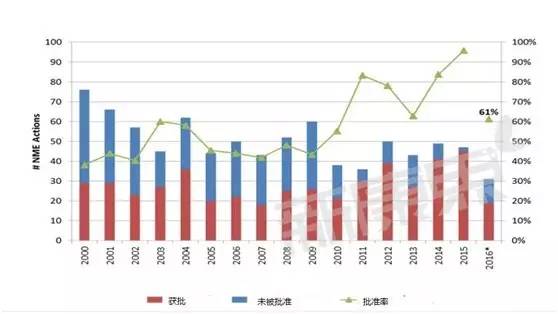
批准率变化情况
上图统计了每年提交的NME申请最终被批准的情况,值得说明的是2015年提交的申请不一定在当年就被批准,有可能过一年甚至数年才被批准;同时被退回重新申请的被批准之后也统计为获得批准;另外,一次性申请多种剂型、多种适应症的情况视为一次申请。可以看到从2010年开始,批准率有逐年升高的趋势,2016年较低是因为有的申请还在审理之中,不能被归为获得批准一类里。
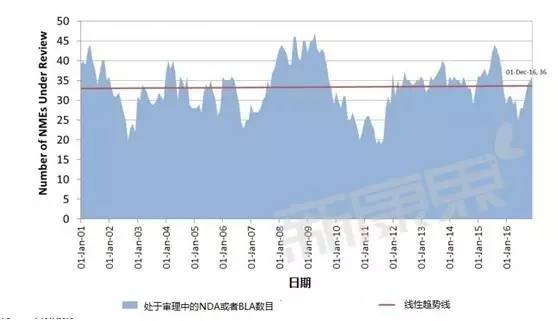
处于审理之中的药物数量变化情况
处于审理中的新分子实体数目是个连续的动态变量,不太好用分类变量常用的直方图表示,因此上图采用了线性的阴影面积图。可以看到FDA正在处于审理中的新分子实体数目保持在33个左右,最近十几年其工作容量和效率变化不大。
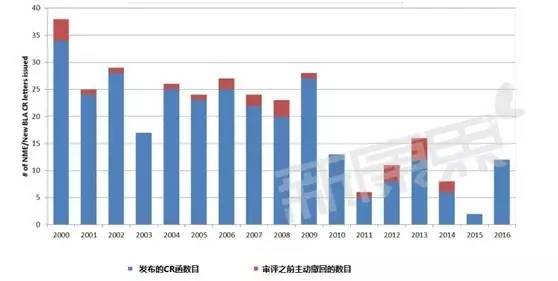
FDA发布的的全项审评意见函(Complete Response letters)数目变化
所谓全项审评意见函(Complete Response letters)类似于国内的补充通知,是FDA以书面的形式向申请者发送的函件,其中完整描述了FDA发现的提交申请资料中所有缺陷和不足之处,指导申请人补充资料以便能够获得批准。可以看到最近几年CR函有逐年减少的趋势,2015年降低到历史最低点,因此这一年被批准的新药也最多,而2016年CR函件又多了起来,今年被批准的新药也有所回落。
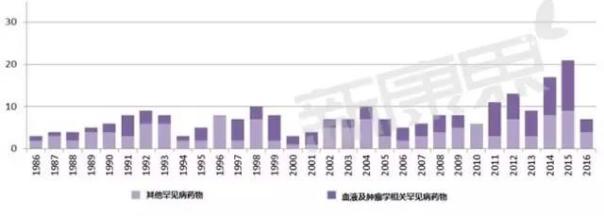
罕见病药物审批情况
FDA很早就给出了罕见病的定义,罕见病由于患病人数较少,因此药物开发很难获利。为解决这一问题,FDA给予了罕见病药物孤儿药研发企业很多优惠条件,这样罕见病药物也成了各大生物医药公司研发的热门,从上图中也可以看出罕见病治疗药物被批准的数目也有逐年上升的趋势。

分享到:








 相关新闻
相关新闻