不凡的启航:三个超级生物类似药获批
作为全球最大的创新原研药的动力源,美国每次公布的新药信息都吸引了全球专业人士的目光,因为它们中的某些新药可能代表着下一个热门领域,对未来研发有着风向标的作用。
例如:2015年全球首个anti-CD38抗癌单抗Darzalex(daratumumab)获批,市场预计该药销售将达到数十亿美元;2016年全球首个PD-L1抑制剂Tecentriq(atezolizumab)获批,以及近几年来先后在欧美获得首批的PD-1抑制剂、IL-17A单抗及PCSK9抑制剂等,标志着药物研发新变革的到来。
前三季度药审总体印象
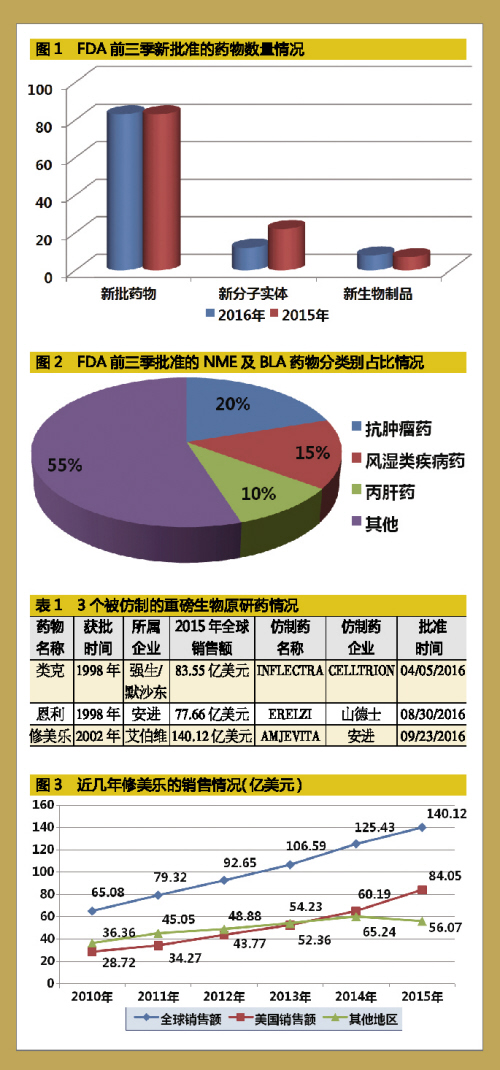
2016年前三季,FDA共批准了12个新分子实体及8个新生物制品,少于去年同期。
7月11日,FDA在拒绝9个月后,批准了Shire公司浓度为5%的药物Xiidra用于治疗干眼症。这是FDA批准的首个治疗干眼病的淋巴细胞功能相关抗原1(LFA-1)拮抗剂类新药,同时也是美国市场中唯一一种处方滴眼液。由于Xiidra是过去13年里干眼病治疗领域的首个新药,业界对其商业前景十分看好,预计年销售额将突破10亿美元。同时,Xiidra将成为艾尔健干眼病药物Restasis强有力的竞争对手。2015年,Restasis销售额突破10亿美元大关。
如果将FDA前三季新批药物按照治疗疾病种类来分,其中抗癌药、风湿性疾病治疗药及丙肝药占据前三甲。但是,最具看点的领域是3个生物类似药的获批,它们分别对应超级重磅生物原研药Remicade(类克,Infliximab)、Enbrel(恩利,Etanercept)以及Humira(修美乐,Adalimumab)。
“药王”修美乐的未来趋势
近些年来,生物药在多个重大疾病治疗领域显示出明显的临床优势,是生物药持续火爆的原因。例如上述原研药,在销售非巅峰期的情况下,3个重磅原研药2015年的销售额合计高达300多亿美元还是令人咋舌。
原研药虽好,但高昂的价格对病患的承受力来说是个挑战。随着原研生物药专利到期及生物技术的不断发展,生物类似药的研发及获批消息越来越吸引人们的眼球。
这当中最令世人侧目的是“药王”修美乐的生物类似药Amjevita的获批。自2013年销售首次突破百亿美元以来,修美乐已经连续3年创下了过百亿美元的销售成绩,并且2016年其上半年销售额就已经高达77.26亿美元,标志着第四年销售过百亿美元的纪录已没有悬念。虽然暂时还没有达到上一个“药王”立普妥连续7年销售过百亿美元的销售纪录,但是因生物制剂本身的特殊属性,生物类似药即使上市对原研药的冲击也会小于化学药。
因此有机构预测,随着2018及2021年其欧洲日本专利才会陆续到期,修美乐还将出现6个年销售额超过百亿美元的情况。唯一担心的是其近几年销售的快速增长主要来自美国市场,因此应对Amjevita对修美乐在美国市场的销售影响是艾伯维眼下最重要的任务。
【结语】
总体来说,2016年前三季新获批的药物数量虽与上年同期持平,但获批的新分子实体及新生物制品明显少于去年同期,并且拥有孤儿药称号以及优先审评身份的药物也少于去年同期。
不过,以以往经验判断,第四季是FDA批准药物的密集期,因此今年获批的新药应该不会少于27个。虽然与2015年高峰期的47个相比差距不小,但前三季3个超级重磅原研药的生物类似药的获批,标志着2016年也将是一个不平凡年份。

分享到:









 相关新闻
相关新闻