
全球生物制药迎来复苏:浅析行业发展趋势及挑战
判断生物制药行业是否景气有个重要指标:获批并上市的新药物的数量。经历了长期的今年估计衰退后,近期生物制药行业迎来了复苏。除此以外,行业的一些其他的主要发展和趋势也可以帮助我们进一步地了解这个行业的情况,对行业现状进行更加精确地评估,并对将来作出预测。这些趋势已经以年度评点的形式发表在相关期刊,行业的各个重大事件都在该文中提及。
头条新闻是埃博拉病毒
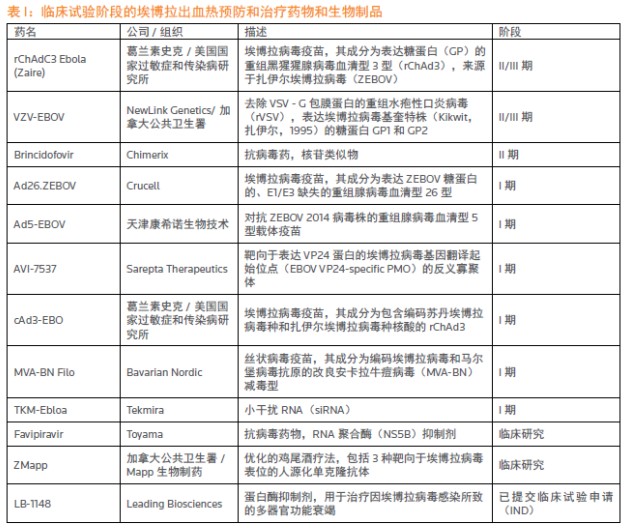
2014年医疗方面最重大的新闻是西非爆发的埃博拉疫情。截至2015年2月20日,全球共有2.34万人感染埃博拉病毒,9450人因此死亡。这次埃博拉疫情是历史上最大的一次,并且首次影响到西方国家。疫情爆发前,只有极少数针对埃博拉病毒的药物和疫苗,而且这些在研产品都还处在临床前试验阶段。但疫情爆发后几个月,随着受感染人数“火箭式”迅猛增加,在各个机构包括世界卫生组织(WHO)、美国国家过敏和传染病研究所(NIAID)和美国疾病预防控制中心(CDC)的鼓励和支持下,制药公司开始努力开发预防埃博拉病毒的疫苗和治疗该感染的药物。这直接导致,到去年年底,有12个产品进入临床研究阶段(见表1)。虽然所有的迹象都表明,这些候选疫苗和药物基本上没有可能及时获得监管部门的批准,在这次疫情中发挥作用,但是在如此短的时间内制药行业取得如此大的进展,足以展示当面对大规模健康危机时,公共健康机构和制药公司的应对能力。
人见人爱的孤儿药
用于罕见病的孤儿药虽然针对的患者群很小,但由于投资回报率非常高,所以制药公司此类药物的开发越来越予以重视。这一变化的结果显而易见:2014年首次上市的84个新药中有15个在上市地区获得孤儿药地位,比例将近18%。与此相对应,自1983年美国孤儿药法案颁布后的十七年间,总共只有34个罕见病药物上市。
目前,人类已经发现了大约7000种罕见病,所以有足够的空间留给制药公司去发挥,创造出类似Ataluren(Translarna)的成功范例。去年,这个用于治疗杜氏肌营养不良症的药物在欧盟获得批准,并已经在德国上市销售。
2014年,美国、欧盟、日本和澳大利利亚的监管机构给予超过400种药物孤儿药地位。这些孤儿药中,大多数是用于一些罕见的癌症或者是先天性代谢缺陷的,其他的适应症包括多发性硬化症、囊性纤维化、埃博拉病毒感染、真菌感染和色素性视网膜炎等。
不断“刷新”的在研产品线
有限的资源、严格的监管要求加上来自于竞争对手和股东的持续不断的压力,所有这些因素都迫使制药公司不断地对在研产品进行淘汰,只留下最有希望的候选药物。将已经进入到后期阶段临床试验的在研项目停止原因很多,包括疗效不佳、安全性问题、患者入组或研究设计问题,或者处于战略性的考虑,比如市场规模、获批的可能性、资源的再分配以及在研产品线的优化。
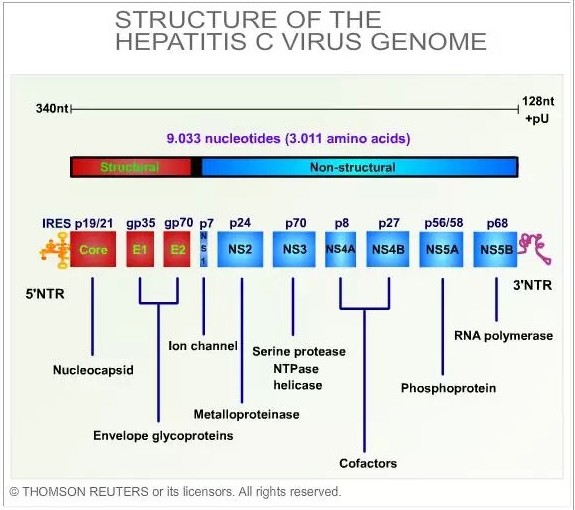
有时候,一些公司的好消息恰恰是另一些公司的坏消息。最明显的例子莫过于去年的丙肝药物治疗市场,这个领域在过去五年发生的变化令人目不暇接。在2011年前,还没有任何用于丙肝治疗的特异性酶抑制剂面世,当时最好的治疗方法是干扰素加广谱抗病毒药物利巴韦林。但这个方法只能部分消灭病毒,而且需要长期治疗,并会导致严重的、令人虚弱的副作用。大约十年前,科学家们对丙肝病毒有了更多的了解(见图1),使得研究人员得以设计出靶向于丙肝病毒生命周期的药物。其结果就是,从2011年开始,新的直接作用于丙肝的药物如潮水一样被开发出来。最早的产品是2011年上市的丙肝病毒NS3蛋白酶抑制剂boceprevir和NS3/NS4A蛋白酶抑制剂telaprevir。随后,又有六个新的丙肝药物和两个个固定剂量的复方药成功上市。
图1:丙肝病毒基因组结构
由于众多新的抗丙肝药物迅速冲进市场,去年一些公司决定不再继续对在研产品线中的同类产品进行投资,以减少损失。比如勃林格殷格翰(Boehringer Ingelheim)就砍掉了两个项目:聚合酶抑制剂deleobuvir和丙肝病毒NS3蛋白酶抑制剂faldaprevir。行业内几十个在研的同类产品使得勃林格殷格翰做出这个务实的决定。
中风治疗药物的开发非常困难,临床试验成功率很低。2014年12月,灵北(Lundbeck)公司宣布决定中止开发用于急性缺血性脑卒中的重组纤溶酶原激活剂去氨普酶(desmoteplase),同时停止DIAS-4试验的患者招募,原因是之前DIAS-3试验数据的分析发现,这个药不可能达到DIAS-4试验的主要终点。这个药物安全性良好,而且某些患者可以从治疗中获益,但是公司没有考虑清楚应该选择哪一类亚组患者进行进一步的研究。灵北公司目前正在评估各种方案,其中包括不再继续开发去氨普酶项目。另一家公司Cytomedix去年也停止了中风药物ALD-401的开发,原因是疗效不佳。
查格斯氏病(Chagas disease,也称美洲锥虫病)是一种传染病,每年在拉丁美洲有几百万人感染此病。但是,被忽略疾病药物组织(Drugs for Neglected Diseases Initiative,DNDI)宣布不再继续资助E-1224的开发,原因是单药治疗的II期临床试验结果显示,该药缺乏持续疗效。这一决定使得原本就只有三个的用于查格斯氏病治疗的在研药物减少到两个。好消息是,DNDI宣布E-1224与苄硝唑联合治疗的研究即将进行。

分享到:








 相关新闻
相关新闻