肿瘤免疫疗法是近几年来癌症治疗领域最成功的方法之一,目前主要分为两个分支:细胞治疗免疫和免疫检查点抑制剂治疗(ICB)。免疫检查点分子是免疫系统中起抑制作用的调节分子,其对于维持自身耐受、防止自身免疫、以及通过控制免疫应答的时间和强度而使组织损伤最小化等至关重要。免疫检查点分子表达于免疫细胞上,将抑制免疫细胞功能,使机体无法产生有效的抗肿瘤免疫应答,肿瘤形成免疫逃逸。免疫检查点抑制剂类药物,可解除这种抑制作用,让免疫细胞重新激活工作,消灭癌细胞。
然而,令人遗憾的是,免疫治疗并不是对每个人有效,只有一小部分人可以从中获益(10%-40%,据文章中的数据),虽然研究人员们已经明白这种疗法与个体MHC的基因型有着一定的关系,但是根本原因却尚不明晰。值得关注的是,在年轻和女性癌症患者上, 免疫检查点抑制疗法疗效甚微,甚至完全不起作用。
近日,加州大学圣地亚哥分校医学院的研究人员在Nature Communications 杂志发表了题为:Strength of immune selection in tumors varies with sex and age的研究论文,发现了一些可以解释“为什么年轻的女性患者对某些癌症免疫治疗的反应特别低”的证据。

其实,在先前的一些研究中,已经有一些证据累积证明免疫反应存在二型性(dimorphism)。由于基因和激素水平的不同,在注射流感疫苗之后,女性的抗体免疫反应是男性的两倍并且拥有更多的CD4+ T细胞数。除此之外,女性也更易罹患自身免疫性疾病,表明免疫系统造成的疾病在性别当中也表现出了不平衡。在800多免疫序列测试选择中,HLA(人类白细胞抗原human leukocyte antigen)的传播选择以及CD8+ T细胞的扩增都反映出了性别相关的差异。
不光在性别上,随着年龄的增加,人体的免疫反应也会随之减弱。年轻人在大多数情况下具有更强的免疫反应,但这并不意味着癌症免疫疗法会对他们更有效。
在此项研究中,研究团队从美国国立卫生研究院(NIH)的《癌症基因组图谱》中查阅了近1万名癌症患者的基因组信息,以及从国际癌症基因组联盟数据库和已发表的研究中查阅了其他肿瘤类型的342名患者的基因组信息。
可呈递的癌症驱动基因更少
首先,研究人员通过对比MHC-1突变与没有MHC-1的患者进行对比,发现这些患者中PHBR-1和PHBR-2的分布没有显著差别。MHC呈递的总体相似性表明,诊断时的性别和不同年龄的患者均具有大致相同的癌症驱动基因突变,这意味着由特定等位基因组合产生的MHC呈递的特异性不是引起ICB应答率差异的机制。
因此,作者认为差异可能是由于免疫选择强度的差异所致,例如,具有较强免疫编辑能力的肿瘤应保留较少的驱动突变,而这种突变可由患者自己的MHC分子呈现给T细胞。对于每个队列中的性别和年龄特定组,我们比较了在患者肿瘤中RNA表达的驱动子突变的PHBR-I和PHBR-II的分布。性别和年龄组之间观察到的癌症驱动基因数量没有显著差异,在未观察到癌症驱动基因突变的病人组中,年轻女性患者的比例过高(费舍尔精确检验:I类:OR = 1.12,p < 0.12; II类:OR = 1.28,p < 0.015)。我们注意到,这一组的甲状腺癌病例过多,这是一种与低突变负担相关的疾病,通常只有一个癌症驱动基因突变。因此,我们对2900位独特的患者进行了针对性别的分析,并对3928位独特的患者进行了针对年龄的分析。
在整个癌症人群中,女性因其MHC-I和MHC-II分子呈现驱动突变而处于显著劣势(PHBR得分较高)。年轻的患者也倾向于通过MHC-I和MHC-II分子表现出更差的驱动基因突变。值得注意的是,组之间PHBR的分布的变化发生在弱结合阈值附近。鉴于有限的体细胞突变会产生突变肽,而且并非所有突变体都是免疫原性的,因此这种微小的变化可能转化为产生对ICB产生宿主抗肿瘤反应的机会明显减少。
总而言之,这表明得分差异确实是由遗传的MHC基因型与观察到的突变的相互作用造成的。有趣的是,针对女性和年轻患者,映射到这些驱动子突变的RNA外显子的突变特异性部分明显更低,进一步支持了免疫选择中基于性别和年龄的差异强度。
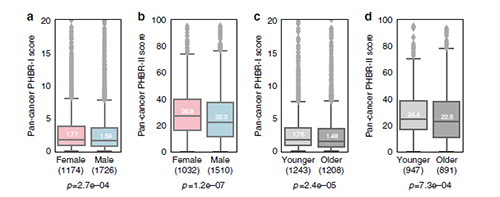
(图片来源:Nature Communications)
突变信号不能解释差异选择
为了排除这种差异是由不同人群接触的外界突变信号所导致的,作者将特定的突变分配给不同的诱变过程,从而可以探索不同性别和年龄的环境暴露差异。研究人员比较了每种肿瘤类型中突变信号的性别特异性发生率,仅发现少数信号强度较弱但与性别显著相关的实例。因此这表明环境暴露对免疫选择对癌症突变基因的性别特异性影响的影响非常低。此外,当排除具有显着特征差异的肿瘤类型(多形胶质母细胞瘤,GBM和肝肝细胞癌,LIHC)时,研究人员仍然观察到性别和年龄相关的差异。此外,只有两个特征与年龄相关,这两个特征都与衰老相关联。我们检查了C> T和T> C突变,发现在诊断时这些类别中观察到的癌症驱动局因突变在年龄上分布广泛。那么假使老年人的免疫选择较弱,与其他突变相比,与年龄相关的突变则一定会表现得更好(PHBR得分较低)。相反,在所有可能的MHC-I和MHC-II等位基因中,C> T和T> C突变的表现比其他突变显着更差(PHBR分数略高)。因此,文章认为 性别和年龄对免疫选择的影响不太可能是由于环境暴露差异所导致的。
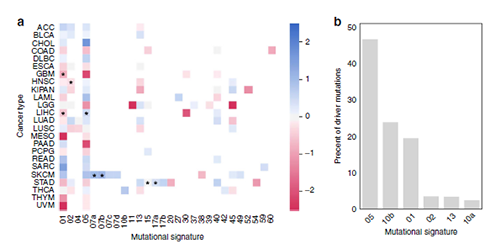
(图片来源:Nature Communications)
在非TCGA独立人群中进行验证
随后,作者又寻求了从国际癌症基因组协会(ICGC)数据库中已发表的dbGaP研究和非TCGA样本汇编的342名患者人群中对我们的发现进行验证,并过滤以排除TCGA中未显示的肿瘤类型。尽管相对于发现队列而言,代表的肿瘤类型较少,但是这些患者在诊断时的性别和年龄方面各不相同,男性略多于女性,并且平均癌症驱动基因突变数相似。在MHC-I和MHC-II中,年轻女性再次表现出比男性更严重的驱动突变(p < 0.001,p < 0.007)。
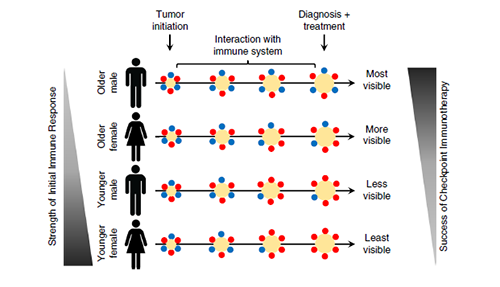
当我们在关注肿瘤免疫疗法突飞猛进的新进展,不断开发新疗法的同时,也要明白目前的疗法还有很多机理可以进行挖掘,从而使这些新兴的生物疗法更为我们所用,获得更好的效果。我们对肿瘤和免疫系统之间的相互作用了解得越多,我们就能更好的针对每个人的情况定制个性化的治疗方案。本文通过深入探究性别以及年龄与免疫检查点抑制剂疗效之间的关系,进一步缩小了该疗法的适用范围,在肿瘤个性化的治疗上又前进了一步。
参考文献:
Castro, A., Pyke, R.M., Zhang, X. et al. Strength of immune selection in tumors varies with sex and age. Nat Commun 11, 4128 (2020). https://doi.org/10.1038/s41467-020-17981-0
关于美迪西
美迪西(股票代码:688202)成立于2004年,总部位于上海,致力于为全球制药企业、研究机构及科研工作者提供全方位的临床前新药研究服务。美迪西的一站式综合服务以强有力的项目管理和更高效、高性价比的研发服务助力客户加速新药研发进程,服务涵盖医药临床前新药研究的全过程,包括药物发现、药学研究及临床前研究。美迪西与国内外优质客户共同成长,为全球超过700家客户提供新药研发服务,美迪西将继续立足全球视野,聚力中国创新,为人类健康贡献力量!
联系我们
Email: marketing@medicilon.com.cn
电话: +86 (21) 5859-1500(总机)












 相关新闻
相关新闻