在肿瘤免疫治疗领域,PD-1抑制剂自首次露面以来就一直带着光环,临床试验、审批阶段都受到相关机构的加速批准待遇。自2014年全球首个该类药物获得批准以来,国外各企业高度聚焦,临床试验也是加紧进行。让人欣慰的是,国内企业也毫不示弱,截至2016年2月底,已经有4家本土企业积极投入到这场激烈战斗中。
随着精准医疗概念的提出,有关免疫治疗与肿瘤基因突变关系的研究得到越来越多的关注。在卫计委重大新药创制2015年重点研究方向中,提出研发重点要针对恶性肿瘤等重大疾病,并进一步聚焦为靶向及免疫抗肿瘤药物,还提出了推荐的药物靶点,包括PD1、PD-L1靶点,明确范围无疑将使国内制药企业研发目标更准确。
目前国外已上市的抗PD-1/PD-L1药物是百时美施贵宝(BMS)的Opdivo(Nivolumab)和默沙东的Keytruda(Pembrolizumab),其他处于在研阶段的药物有Pidilizumab(CT-011,CureTech)、Avelumab(默克)、BMS-936559(MDX-1105,BMS)、Atezolizumab(MPDL3280A,罗氏)和MED14736(阿斯利康)。
查询CDE数据发现,近两年,在国内PD-1/PD-L1市场中也出现一批领先“玩家”,包括君实生物、恒瑞医药、百济神州、嘉和生物等,泰州君实和江苏恒瑞先后获得了临床试验批件,目前没有在中国上市者。
全球专利技术情况
从PD-1抗体专利技术布局来看,抗体专利申请量最多,其次是抗受体、抗肿瘤药、DNA重组技术、受体表面抗原等。
从权利人来看,专利最多的公司是日本小野制药(ono pharmaceutical)和达纳法伯癌症研究机构(dana-farber cancer institute)。
从PD-1抗体专利市场布局来看,美国是各大药企最重要的市场,各申请人在美国共布局了156件专利,基本覆盖全部技术类别;欧洲、日本和中国也是各大药企竞相追逐的市场;此外,奥地利、阿根廷、秘鲁、波兰等国均有专利布局。
国外研发进展上市药物
●Opdivo(Nivolumab,纳武单抗)
●2020年销售额预计:88亿美元
2014年7月,Opdivo(nivolumab)率先在日本获批用于治疗晚期黑色素瘤,成为全球首个批准上市的PD-1抑制剂。
Nivolumab由BMS和小野制药共同开发。截至目前,Opdivo已经在46个国家获批上市(不含中国)。Opdivo因疗效显著而4次临床试验提前结束,因此FDA只用了4个工作日便批准其鳞状非小细胞肺癌适应症,创审批速度新纪录。
BMS的2015年年报显示,Opdivo第四季度销售增长至4.7亿美元,全年贡献了9.42亿美元。
据EvaluatePharma预测,Opdivo(Nivolumab)将成为PD-1/PD-L1领域最成功的免疫疗法,2020年销售额将达到88亿美元。
●Keytruda(Pembrolizumab,派姆单抗)
●2020年销售额预计:55亿美元
默沙东的Keytruda通过企业收购获得。2014年,该药的上市申请启动,并获得突破性治疗药物资格,于2014年9月4日获FDA批准,比限期日提前50天,成为FDA批准的第一个PD-1抗体药物。默沙东就该药与辉瑞、安进及Incyte达成合作协议,将其与其他抗癌药合用以扩大适应症范围。
默沙东2015年年报显示,Keytruda第四季度累计2.14亿美元,全年销售达5.66亿美元。
据EvaluatePharma预测,Keytruda(pembrolizumab)2020年销售额将达到55亿美元。
其他在研药物
●Atezolizumab 2015年8月,罗氏宣布,其开发的PD-L1药物Atezolizumab(代号MPDL3280A)在一项治疗非细小性细胞肺癌的Ⅱ期临床研究中取得重大成功,公司将凭借这一结果向FDA寻求加速审批,以追上在前面的Opdivo(BMS)和Keytruda(默沙东)。
●Avelumab 2015年11月,默克(Merck KGaA)和辉瑞合作开发的抗PD-L1免疫疗法Avelumab被FDA授予治疗既往已接受至少一种化疗方案的转移性Merkel细胞癌患者的突破性药物资格。2015年9月和10月,FDA已授予Avelumab孤儿药地位和快车道地位。目前,Avelumab的临床开发项目涉及超过15种肿瘤类型。
●Durvalumab 阿斯利康的Durvalumab(代号MEDI4736)是一种PD-L1抑制剂,用于治疗非小细胞肺癌的研究处于Ⅲ期临床阶段;对黑色素瘤的研究处于Ⅰ期临床阶段。对结直肠癌的研究处于Ⅱ期临床阶段。目前,其他竞争对手尽管已将结直肠癌列为研究的一部分,但尚未针对结直肠癌开展专门研究。因此,阿斯利康推进其PD-L1抑制剂项目MEDI-4736至结直肠癌,将开启一个潜在的一鸣惊人的机会。
●Pidilizumab CureTech公司的Pidilizumab(代号CT-011)是针对PD-1的重组单克隆抗体,目前处于Ⅱ期临床研究阶段,拟适应症包括大B细胞淋巴瘤、胶质细胞瘤和多发性骨髓瘤。
临床客观缓解率
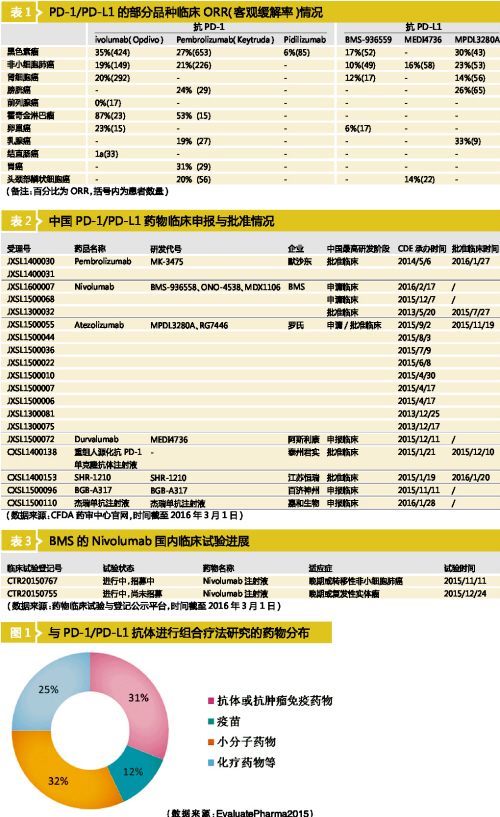
2015年8月,期刊《Current Opinion in Pharmacology》汇总了PD-1/PD-L1的部分品种及部分临床,翻译后如表1所示。Opdivo对黑色素瘤的客观缓解率达到35%,对比来看,仍处于研究阶段的Pidilizumab就有些差强人意,仅有6%的客观缓解率。在2016年初,FDA暂停了Pidilizumab的部分临床试验。PD-1/PD-L1靶点研发火爆,但并非都是道路平坦。
国内研发申报情况
根据CFDA及CDE网站提供的数据,目前国内暂无抗PD-1单克隆抗体获批生产。但临床研发活跃,主要涉及4家国外企业和4家国内企业的8个产品。
2016年1月28日,沃森生物子公司嘉和生物研发的抗PD-1单抗(杰诺单抗注射液)产品临床研究申请获得CDE的受理。至此,国内共有4个厂家参与到PD-1/PD-L1的激烈争夺战中,包括恒瑞、百济神州、泰州君实。默沙东、BMS、罗氏、阿斯利康也在积极开展该类药物中国的临床试验(见表2)。
国外企业在国内的临床试验
查询CDE药物临床试验与登记平台,数据显示,Nivolumab已在积极开展临床试验,BMS于2013年5月30日向CDE提出该药临床申请,是国外该类药物企业最早在国内申报临床的。CDE于2015年7月27日批准了该临床试验,其用于晚期或转移性非小细胞肺癌、晚期或复发性实体瘤的临床试验正在进行(见表3)。
CDE数据显示,罗氏的Atezolizumab(MPDL3280A)自2013年12月开始,截至目前一共提交了9个临床试验申请,其中一项于2015年11月19日获得临床批件。默沙东的Keytruda(pembrolizumab)于2016年1月27日获得临床批件。阿斯利康的Durvalumab(MEDI4736)在2015年12月提交了临床试验申请,CDE正在审核中。
国内企业的临床试验开展
3月2日,中山大学肿瘤防治中心贴出了招收国产人源化抗PD-1单抗患者的通知,临床试验使用的是泰州君实生产的国产重组人源化PD-1单克隆抗体注射液JS001。
泰州君实的重组人源化抗PD-1单克隆抗体注射液在2015年12月获得CDE临床批件,成为国内首家PD-1单抗获批临床的企业,该药预计将在2020年上市销售。
随后,在2016年1月20日,江苏恒瑞的SHR-1210获得临床批件。恒瑞与美国Incyte公司在2015年9月达成协议,恒瑞医药将具有自主知识产权的SHR-1210项目有偿许可转让给美国Incyte公司,交易额达7.95亿美元,这是中国企业首次实现了从进口美国医药技术变成出口创新药技术的转变。
百济神州与嘉和生物的PD-1药物临川申请仍在受理中。2016年1月,百济神州的PD-1单抗BGB-A317通过FDA的新药研究申请审评,可在美国开展临床试验。嘉和生物的杰诺单抗注射液主要的潜在适应症包括各种血癌及黑色素瘤、非小细胞肺癌、肾癌等多种实体瘤,是目前最后申报的企业。
组合疗法的利弊衡量
PD-1单抗开发火爆,各大企业纷纷开展外部合作,火速推进各自的临床项目,设想并尝试与各种上市或没上市的药物联用,以彻底发掘该类药物的最大临床潜力。
EvaluatePharma的报告显示,目前有多家企业在研究PD-1/PD-L1抗体与其他药物的组合,组合药物包括疫苗、小分子药物、化疗药物、免疫抑制剂等。从数据来看,与其他药物组合的研究占据了31%(见图1)。
2015年10月,FDA批准Opdivo与Yervoy(ipilimumab,依匹木单抗)合并用于黑色素瘤患者治疗,Yervoy是CTLA-4抑制剂。这是首个也是唯一一个获FDA批准用于癌症的两联免疫肿瘤药物疗法。
不过,目前生存期延长2.5~6个月才被认为具有临床意义,何种药物组合可达到这个新标准还有待研究。应深入开展多种临床试验,从而发现免疫治疗药物的最佳用药方案。
此外,免疫疗法也显示出比较严重的副作用,尤其是复方组合。根据适应症的不同,免疫疗法与不同的化疗或靶向疗法组合,但有些组合毒性太大,疗效一般。所以,免疫疗法到底能对多少肿瘤起到重要作用还有待观察。
2015下半年,FDA曾紧急叫停了一个临床试验。这个试验是PD-1抑制剂和靶向药物AZD9291的联合用药,同时使用这两个药物毒性增强,病人不能耐受。
结语
据花旗预测,2020年PD-1/PD-L1抗体全球市场规模将达到350亿美元,2015-2020年复合增长率达到惊人的61%。未来10年,将有超过60%的癌症患者接受免疫治疗。免疫治疗的良好疗效、广阔的市场空间,吸引着众多药企巨头投入其中。
我们看到,在抗肿瘤领域,国内企业一直紧跟国际研发潮流,加上国家政策的支持,相信国内患者很快就能用上该类药物。
医学的发展总会给我们带来希望,未满足的临床需求终会被满足。









 相关新闻
相关新闻