2015年,按照国务院“四个最严”的要求,国家食品药品监督管理总局加大监管执法力度,启动了药品医疗器械审评审批制度改革,以着力提升中国制造药品医疗器械质量。
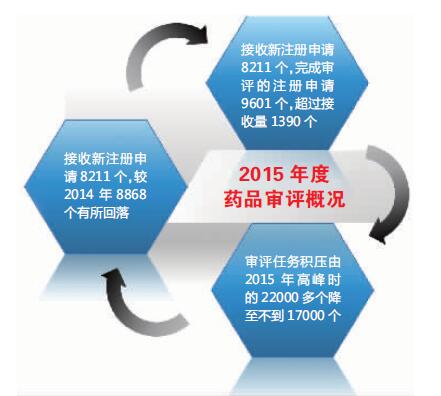
改革一年来成效如何?3月3日,国家食品药品监督管理总局药品审评中心(以下称药审中心)发布《2015年度药品审评报告》(以下称《报告》)。《报告》显示: 2015年,药审中心全年接收新注册申请8211个(以受理号计,下同),全年完成审评的注册申请共9601个,超过年度接收量1390个,实现了完成量大于接收量。
审评积压下降
据悉,按照国务院、国家总局党组关于药品审评制度改革的要求和工作部署,2015年,药审中心在改革审评管理制度、改进用人机制、强化审评质量管理等方面推出了多项改革举措,以全力推进审评制度改革。为消除审评任务大量积压这一障碍,2015年药审中心坚持改革制度和消除积压并行,通过开展专项审评工作、整合审评人力资源等多措并举,全力解决审评任务积压。
经过各方努力,药审中心2015年完成审评任务9601件,比去年全年完成量增加了近90%。审评任务积压由2015年高峰时的22000多个降至2015年底的不到17000个,实现了年初确定的工作目标,解决审评积压的各项举措初显成效。
特别值得注意的是,此前积压较多、排队时间最长的验证性临床和ANDA(申请临床试验)两个任务序列在2015完成量大幅增加,验证性临床在2015年完成2725个,这个数字在2014年是436; ANDA完成量从2014年的587个上升到2015年的3585个, IND、NDA和进口再注册两个任务序列的完成量也平稳增加。
此外,2015年,药审中心立足自身职能,遵循药品注册管理客观规律,积极采取措施推进科学审评,促进行业良性发展,努力做到更好地服务公众。一是鼓励创新药研发。遵循创新药研发规律,对申请临床的创新药审评进行了合理优化,推进创新药尽快进入临床试验,以切实鼓励创新;针对创新药上市申请,重新修订了《化药原料药生产工艺信息表》《化药制剂生产工艺信息表》及《生产工艺信息表确认书》三个文件的提交模板,提高了申报文件的质量,缩短了新药的审评时间;完善国家“重大新药创制”科技专项立项品种的优先审评机制,以鼓励新药创制。
二是完善仿制药审评。配合国家总局构建仿制药BE备案机制,完成仿制药BE备案平台构建,并投入使用;制定仿制药审评报告模板和批件模板,突出研发者主体责任,改进审评组织模式,优化审评流程;梳理重复申报严重的仿制药清单,提供给国家总局发布,引导立题依据不科学、剂型或规格不合理、安全有效性存在问题的品种不再申报;积极探索对高质量仿制药和临床急需仿制药实行优先审评。
三是加强沟通交流。完善日常咨询制度,进一步通过中心网站公开审评信息;完善“申请人之窗”沟通交流申请,以提高沟通交流效率,全年共组织实施了40次针对研发和审评过程中重大技术问题的沟通交流;代拟起草了《药品技术审评沟通交流管理办法》,并上网征求意见;召开了肿瘤适应症创新药临床试验备案制度座谈会、中药审评改革专家座谈会、疫苗审评专家座谈会等会议,增进各方协作,共商鼓励创新机制。
四是推进中药审评改革。在深入分析当前中药审评面临问题的基础上,结合中药审评工作专家座谈会意见,通过定期制定审评计划、调整主审报告部门、强化适应症团队管理、改进审评报告模板和审评理念、加强专家咨询会管理、加快指导原则制定发布等措施,全面开展中药审评改革,提高中药审评效率和质量,助力中医药创新,促进产业发展。
IND中外申报有异有同
《报告》显示,2015年药审中心接收新注册申请8211个,数量较2014年的8868个有所回落,但仍处于高位。其中,化学药7201个,中药358个,生物制品561个,复审91个,化药和中药接收量均较2014年有所下降,生物制品接收量有所增加。
化药注册申请的接收量仍占绝对优势,占总接收量的88.5%。在化学药的注册申请中,新药申报(即IND)最能体现一个国家制药工业的创新能力,2015年化学药IND申请的接收量是360个。
国产IND申报数量较多的治疗领域有:抗肿瘤药物、消化系统疾病药物、内分泌系统药物、风湿性疾病及免疫药物。国际多中心(含进口IND)申报数量较多的治疗领域主要集中在抗肿瘤药物。
对比国产和进口IND,相同的申报热点是抗肿瘤领域。不同的是国内IND申报较多的风湿性疾病及免疫药物、消化系统疾病药物、神经系统药物、抗感染药物等领域,几乎没有进口IND申报。
2015年,药审中心全年完成审评的注册申请共9601个,超过年度接收量1390个,实现了完成量大于接收量。其中建议批准临床4676个,建议批准上市391个,建议批准补充申请1183个,建议批准进口再注册143个,建议各类不批准2208个,另有企业撤回等情况的注册申请1000个。
2015年,多个涉及重大公共卫生领域、具有重要社会价值品种获批上市。我国自主研发的重组埃博拉疫苗、口服I型Ⅲ型脊髓灰质炎减毒活疫苗(人二倍体细胞)、肠道病毒71型灭活疫苗等防控重大流行性疾病的疫苗在2015年获准上市,还批准上市了全球唯一批准用于庞贝病的药物——注射用阿糖苷酶α,以及全球唯一批准的库欣氏病对因治疗药物——门冬氨酸帕瑞肽注射液等。此外,批准了治疗前列腺癌、非小细胞肺癌等恶性肿瘤治疗药物以及针对中医药优势病种开发的中药有效部位新药上市。
部分仿制药依然重复严重
此前,国家总局先后公布了两批过度重复申报药品目录,以更好地引导药品合理申报,促进药品产业健康发展,但就2015年度的报告来看,化药重复申报现象依然存在,集中在ANDA申请和验证性临床方面。
《报告》显示:截至2015年底,待审的化药ANDA申请共7411个,占待审任务总量的42.9%,涉及活性成份1027个。重复申报较严重的有94个活性成份(待审任务量均在20个受理号以上),涉及注册申请3780个,占化药ANDA总任务量的51%。而其中相同活性成份待审任务超过100个的有埃索美拉唑钠、恩替卡韦、法舒地尔,总涉及申请数量414个,但埃索美拉唑钠和恩替卡韦两个活性成份2015年的新申请量仍位列前茅。相同活性成份待审任务在50~99个之间的活性成份有17个,涉及申请数量1221个。
截至2015年底,待审的化药验证性临床申请共3590个,占待审任务总量的20.8%,涉及活性成份660个。重复申报较严重的有40个活性成份(待审任务量均在20个受理号以上),涉及注册申请1393个,占化药验证性临床总任务量的38.8%。其中相同活性成份待审任务超过50个的有沃替西汀、阿普斯特、阿考替胺、曲格列汀、阿伐那非、阿法替尼、阿齐沙坦、卡格列净。
值得注意的是,在2015年新接收化药注册申请中,验证性临床、ANDA、补充申请三类注册申请占化药全年接收量的88.6%,与前三年比较,验证性临床接收量逐年大幅增加,ANDA和补充申请下降较为明显。








 相关新闻
相关新闻