
Emai:marketing@medicilon.com.cn
业务咨询专线:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦东新区川大路585号
邮编:201299
电话:+86 (21) 5859-1500(总机)
传真:+86 (21) 5859-6369


© 2023 上海美迪西生物医药股份有限公司 保留所有权利 沪ICP备10216606号-3


业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




据统计,世界范围内批准的大部分药物以及近年来前500个畅销药物中,接近一半都是单一的对映异构体。早在1960年代,外消旋药物分子中的非目标对映异构体所带来的负面影响就逐渐被认识到,许多母亲由于怀孕期间服用镇静剂沙利度胺而造成数以百计的畸形儿的诞生,后续研究表明产生畸形的原因是活性分子的孪生兄弟-有害的镜像异构体引起的,即沙利度胺外消旋物中的R-(+)-沙利度胺是有药且安全的,而S-(-)-沙利度胺则具有致畸性。
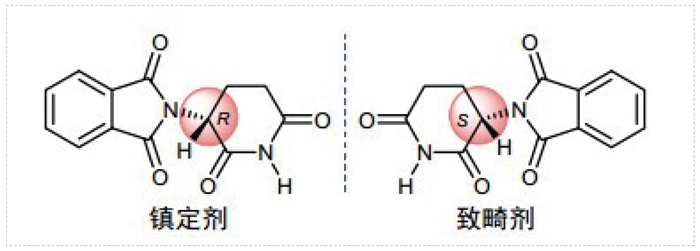
沙利度胺 (反应停)
开发单一构型异构体的动力来源于药物安全的考量和日趋严格的监管要求,另外由于手性药物的对映体在药效学、药代动力学等方面存在较大差异,因此建立手性拆分的方法十分重要。目前一般是通过手性合成或者手性拆分的方法实现手性药物单一(药用)构型的分离和提纯(手性纯度提升),拆分法是制备手性药物(特别是仅含1个手性碳)的经典方法,本文主要介绍手性拆分的相关内容。
当药物分子中碳原子上连接有4个不同的基团时,该碳原子被称为不对称碳或手性碳(中心),会导致药物分子存在异构体,如果两个异构体之间的关系如同一个物体的立体结构在照镜子,这个立体结构和它在镜子中的镜像互为对映异构体(对映体),即手性异构体。
对映异构体的物理性质基本完全相同,例如熔点、沸点、溶解度、折射率、密度、酸度等;红外吸收、紫外、X射线粉末衍射法(XRPD)和差示扫描量热法(DSC)也完全一致。但旋光性存在差异,对偏振光的作用不同,比旋光度数值相同,但方向相反,因此又被称为旋光异构体。
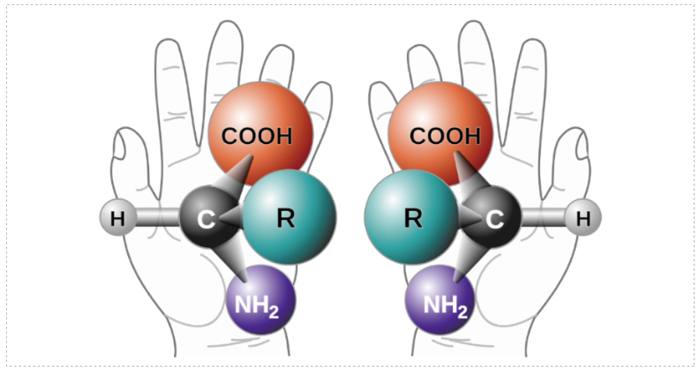
图 1 手性的概念
等摩尔的对映异构体之间不同的分子结合方式也将会带来三种类型的外消旋体,详见下表:
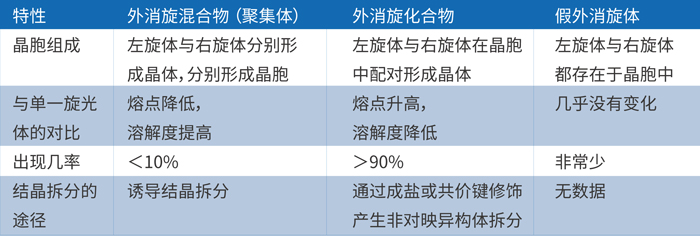
由上表可知,外消旋体的主要存在形式是外消旋混合物和化合物,假外消旋体非常罕见。
对于手性药物而言,活性成分的分子必须与受体分子(比如受体蛋白或酶等)的空间几何结构适配才能发挥药效,由于药物本身存在手性异构,因此对应的两个异构体通常具有不同的生物活性。主要分为以下几种类型:
❖ 两种构型的异构体具有相似或相同的药理活性,例如支气管扩张药特布他林,两种异构体都能选择性地激动气道β2受体,但R构型的药效强于S构型200倍。
❖ 一种构型有效而另一种构型无药理活性甚至起毒害作用,例如R构型的布洛芬临床表现为无任何药理活性且存在胃肠道毒性;与消旋体盐酸西替利嗪相比,盐酸左西替利嗪的剂量减半,而疗效增强,副作用减轻,无明显抗胆碱和抗5-羟色胺的作用,中枢抑制作用较小。
❖ 药理活性不同形成药效互补,例如非阿片类镇痛药盐酸曲马多,两种构型分别发挥不同药效产生协同作用,临床上以消旋体给药效果更佳。
❖ 药理活性不同形成相互拮抗,例如苯哌啶类镇痛药哌西那朵,右旋为阿片受体激动剂而左旋为受体拮抗剂,同时给药将会产生拮抗作用而抵消药效。
1992年FDA发布了关于手性药物的指导原则,要求在向FDA提交的有关新药申请报告中,必须包括对映体的化学、药理学、毒理学以及药代动力学所有相关信息以考虑以单一对映体或消旋体用药的问题。自此,也就衍生了学术界以及制药工艺界对于获得光学纯的手性药物分子方法的研究热潮。2006年12月国家食品药品监督管理局也发布了《手性药物质量控制研究技术指导原则》。在指导原则中规定:手性药物的质控项目要体现其光学特征的质量控制,要求对手性药物不同构型的生物活性(毒性)进行充分研究,并根据研究结果对产品进行质量控制。
手性拆分是指利用物理、化学或生物等多种拆分方法,将已存在的外消旋体通过分离纯化得到单一光学异构体,目前主要有手性色谱拆分、直接结晶拆分和间接结晶拆分等方法。这些方法的局限在于拆分的理论产率是50%,若想要提升该理论产率则应在拆分的同时将不需要的对映异构体外消旋化,使其不断转化为需要的异构体,即将拆分和外消旋化同时进行,从而实现连续的拆分来提升理论产率。
原理:外消旋体通过手性色谱柱实现两种构型的分离,手性色谱柱(Chiral HPLC Columns)是由具有光学活性的单体,固定在硅胶或其它聚合物上制成手性固定相。通过引入手性环境使对映异构体间呈现物理特征的差异,从而达到光学异构体拆分的目的。要实现手性识别,手性化合物分子与手性固定相之间至少存在三种相互作用。这种相互作用包括氢键、偶极-偶极作用、π-π作用、静电作用、疏水作用或空间作用。手性分离效果是多种相互作用共同作用的结果。这些相互作用通过影响包埋复合物的形成,特殊位点与分析物的键合等而改变手性分离结果。由于这种作用力较微弱,因此需要仔细调节、优化流动相和温度以达到最佳分离效果。
色谱拆分方法主要包括气相色谱(GC)、超临界流体色谱(SFC)、毛细管电泳(CE)和毛细管电色谱(CEC)等,其中高效液相色谱(HPLC)因其独特的优势成为手性分析领域最常用的一种技术。
HPLC分离法又分为手性固定相法(CSP)和手性流动相添加剂法(CMPA),前者应用广泛。例如:抗抑郁药物舍曲林的合成新工艺是将手性拆分从最后一步提前到第一步,起始原料使用以多糖为固定相的手性色谱柱进行分离得到(4S)-Tetrolone,收率为98%,异构体(4R) -Tetrolone定量回收且实现消旋化。在依地普仑的生产工艺中,应用模拟移动床色谱(SMBC)实现了手性拆分。
超临界流体色谱(SFC)是一种流动相温度、压力均高于或略低于临界点的色谱技术,所用流动相有CO2、NH3、正丁烷等﹐其中CO2最为常用。超临界流体具有粘度小、扩散系数大、密度高等特点,具有强的溶解能力,可以迅速将产物洗出,且适于分离难挥发和热稳定性差的物质。SFC已经从对手性药物进行分析转向能生产几毫克到几百克样品的半制备或制备规模。益康唑、贝康唑、联苯康唑等抗真菌药物的分离即是通过SFC实现的。
此方法适用于外消旋混合物(聚集体),利用两种构型溶解度的差异,通过结晶的方法使得外消旋体中的理想异构体结晶析出,而另一种构型的异构体则保留在母液中,以此达到拆分的目的。为了促进目标构型析晶,可以加入晶种,例如向外消旋混合物的溶液中加入R构型的晶种,则会选择性的析出R构型的晶体,母液就富余了S构型的化合物;继续加入S构型的晶种,此时就选择性的析出S构型的化合物,该过程可以反复进行至母液中产品纯度降低到杂质影响晶体析出为止。
比较经典的例子是Pasteur于1848年通过缓慢蒸发外消旋酒石酸盐的水溶液,形成大颗粒晶体,借助放大镜用镊子把不同性状的晶体分开, 获得了(+)-/(-)-酒石酸的钠铵盐,但这种案例比较罕见。
该方法适用于外消旋体化合物,可采用与另一手性化合物(即拆分剂, resolving agent)形成非对映异构体混合物的方法,利用这对非对映异构体的溶解度和结晶速率的差异,通过结晶法进行分离,最后脱去拆分剂即得到单一构型的异构体,最常见的拆分剂是手性酸或手性碱。该方法技术相对成熟且成本低,应用范围较广,适合于大规模工业生产且工艺稳定可控。
抗惊厥药普瑞巴林(Pregabalin)采用非对映异构体拆分法合成:1) 以(S)-扁桃酸为拆分剂对外消旋终产物进行手性拆分; 2)以(S)-α-甲基苄胺为拆分剂对关键中间体进行拆分,得到R型异构体,对映体过量值(enantiomeric excess, ee)接近100%,收率为35%, 再通过霍夫曼降解获得S构型的普瑞巴林。
非对映异构体拆分已有一百多年的历史,其技术含量虽不高,但仍然是当今应用最广泛的一种拆分方法。结晶诱导的不对称转化使光学纯异构体的理论收率超过50%成为可能。近年出现了组合拆分、复合拆分、包合拆分和包结拆分等新技术,是对非对映异构体拆分的有效补充。
美迪西手性拆分团队拥有经验丰富的分析分离人员、先进的分析和制备超临界流体色谱仪等设备,依托强大的化学和分析分离经验技术,为客户提供高效的手性拆分服务。确保以具有竞争力的成本、精湛的技术、最快的速度为用户制备毫克级到千克级的手性对映体。
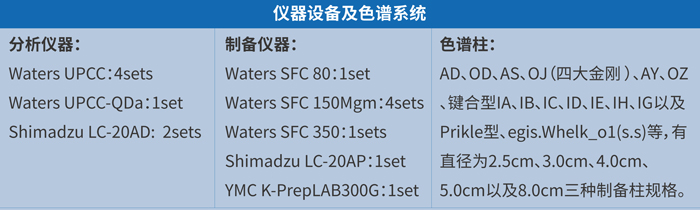

美迪西手性拆分团队积累了丰富的拆分经验和案例,下面简单介绍几个项目案例:
此案例中样品有50g,溶解度大于50mg/mL,通过减少有机相比例,提高流速,增大进样量,循环时间4min,此50g样品在不到10h的时间内完成手性拆分。

流动相MEOH+0.1%MEA,有机相比例20%,流速100mL/min,进样量1mL,分离度不理想
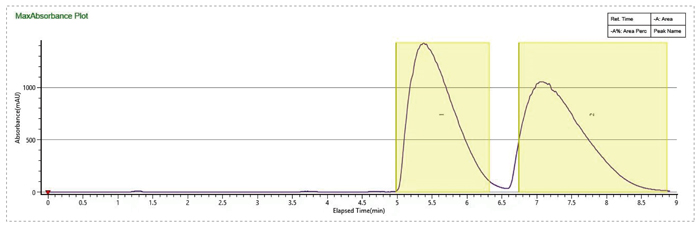
流动相MEOH+0.1%MEA,有机相比例14%,加大流速到130mL/min,进样量提高到5mL,分离效果大大提升
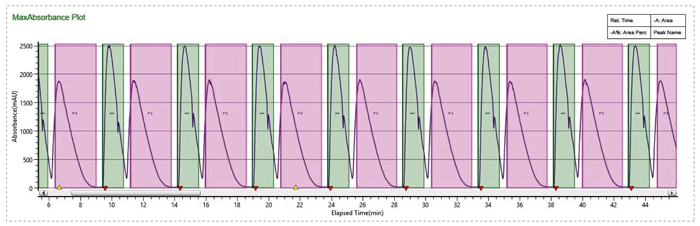
使用SFC循环进样完成样品快速制备
此案例中样品有3g,但溶解性差,用甲醇溶解2L未能完全溶解,如果直接上制备,效率会非常慢,收率也会不高,通过采用混合溶剂溶解样品,并在流动相中也添加助溶剂,制备时间大大提高,收率也提高了。此方案只适合键合型填料色谱柱。

甲醇溶解,流动相比例140-30 MEOH(0.1%MEA),出峰靠后,循环时间较长
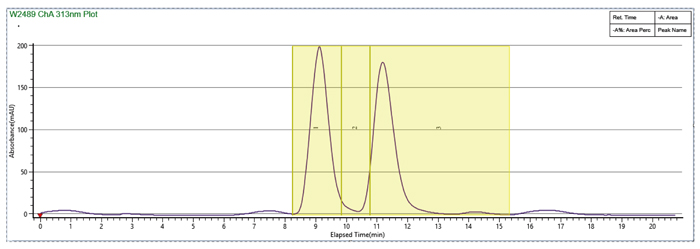
样品溶剂和流动相体系中加入DMSO,MEOH:DMSO=2:1,峰形改善,循环时间大大缩短
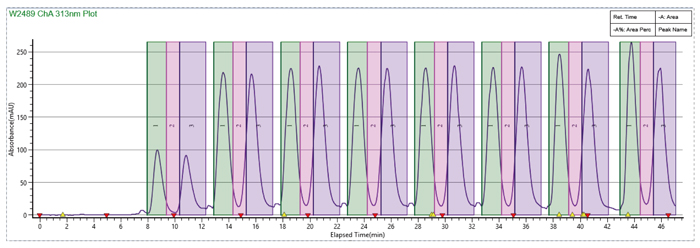
使用SFC循环进样完成样品快速制备
此案例是一个杂质制备的例子,目标杂质峰在主峰后面,离的比较近,分析条件为等度条件,如果直接上反相制备会比较困难。美迪西的解决方案是先用SFC分析开发出富集方法,再用SFC拆分仪器把目标杂质富集,最后用反相制备二次纯化,最终得到纯度为95%以上的目标杂质供结构解析。
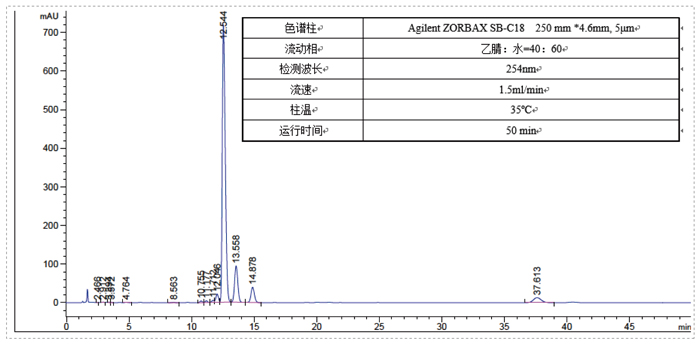
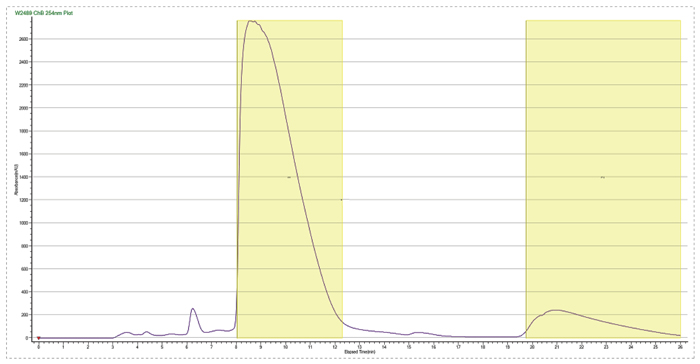
先SFC富集杂质
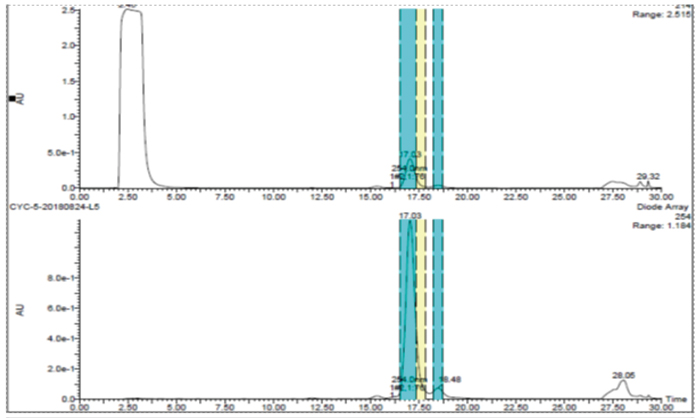
反相制备二次纯化
如下图所示,此案例中化合物A仅有一个手性中心,我们需要R构型对映体。该化合物的溶解性较差,虽然尝试了多种溶解和拆分条件,拆分的产量和效果不太理想,SFC拆分100g消旋体需要2周时间。
因为该化合物pKa呈碱性,美迪西原料药部门系统筛选了20多种手性酸和10余种成盐溶剂,找到了一种纯化效果较好的手性酸。后续通过消旋-拆分-析晶的动态拆分方法,将拆分的收率提高至60%,ee%做到98.5%以上。工艺操作简单,每周可以处理2kg以上的样品,极大地提高了效率,降低了成本。
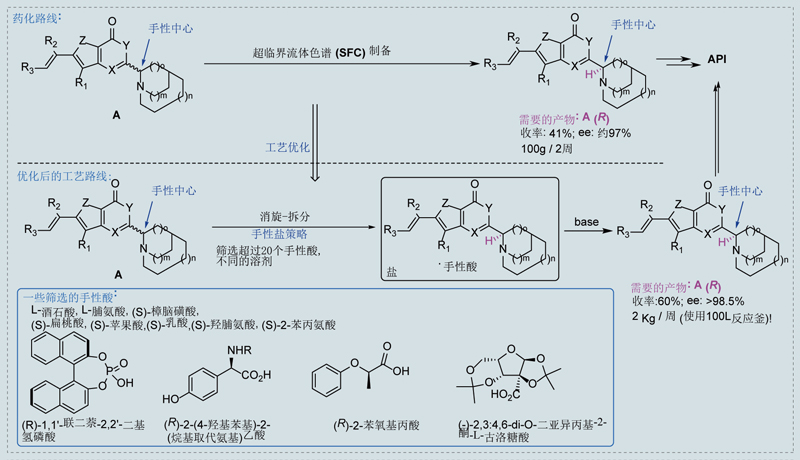
(撰稿:李同全,宋德奎; 编审:邱小龙)
参考文献:
[1] 王耀国,赵绍磊,杨一纯等,手性药物结晶拆分的研究进展[J]. 化工学报, 2019, 70(10): 3651-3662.
[2] Stinson S C. Chiral pharmaceuticals[J]. Chemical & Engineering News Archive, 2001, 79(40): 79-97.
[3] Wang Y M, Chen A. Enantioenrichment by crystallization[J]. Organic Process Research & Development, 2008, 12(2): 282-290.
[4] 刘文强, 李莉, 手性药物及其中间体拆分方法的研究进展[J]. 药学学报,2018, (1): 37-46.
美研|CMC系列回顾
❖ CMC系列(一)|浅谈药物研发中原料药工艺研究的重要性
❖ CMC系列(二)|药学研究之世界银屑病日
❖ CMC系列(三)|高端吸入药物的市场格局和研究现状
❖ CMC系列(四)|浅谈手性药物的研究策略
❖ CMC系列(五)|药物晶型控制策略
❖ CMC系列(六)|含氮类化合物-可挥发碱性有机胺的气相分析
❖ CMC系列(七)|新药研究中的固态开发挑战及应对策略
❖ CMC系列(八)|浅析ICH指导原则Q3C及未收录残留溶剂限度制定方法
❖ CMC系列(九)|定量核磁应用及其方法验证/定量核磁那些事儿
❖ CMC系列(十)|药物杂质研究策略之基因毒性杂质