随着中国经济的高速发展以及不断推进的药政改革,中国医药行业迎来了新的机遇。无论是新药还是仿制药,其开发所必备的“资金、技术、人才、政策”等条件正逐渐成熟,中国医药行业已经迎来了健康快速发展的新时期。
【全球药物研发特点】
“创新药、改良型新药、仿制药”齐头并进
笔者首先从创新药、改良型新药及仿制药三种药物类型,分析全球药物研发的动态和特点。
创新药:仿而优则创
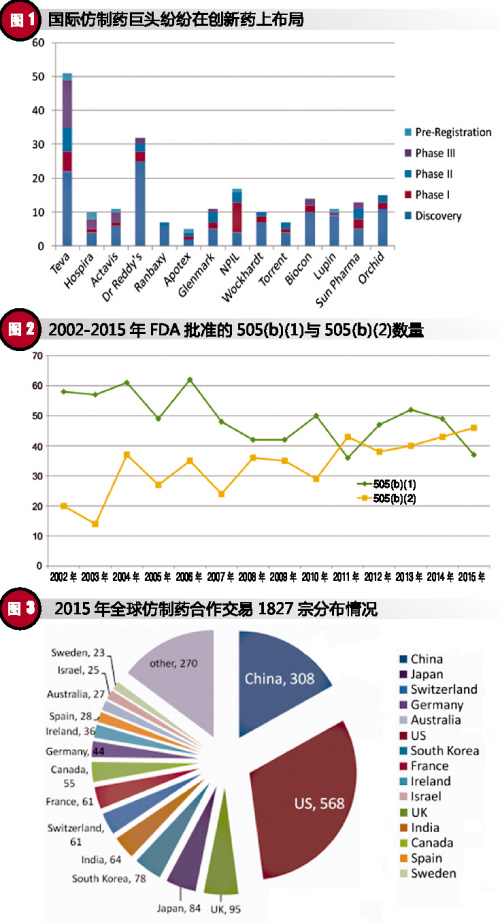
从创新药角度来看,除大家耳熟能详的Pfizer、Roche、J&J、Sanofi等跨国制药巨头外,仿制药领域巨头也纷纷在创新药上布局,并取得了一系列的成绩。以创新药开发数量最多的Teva为例,其销售收入大约有一半来源于创新药。这一点充分体现了“仿而优则创”的必然趋势。
整体来讲,经过仿制药的初步积累,中国创新药最近几年也飞速发展。目前,已经初步呈现出从Me-too/Me-better向First-in-class/Best-in-class阶段的发展。其中,恒瑞医药、正大天晴、先声药业等国内知名企业已经开始引领这个趋势。
改良型新药:永恒的创新类型
从药物生命周期的管理角度,跨国制药巨头们或多或少都会在已有产品的基础上进行产品的改良和升级。从收入占比来看,跨国制药巨头平均有超过1/4的销售收入来源于改良型新药。
从全球新药获批数量来看,改良型新药已经成为新药研发的一种趋势。以美国为例,从2002~2015年FDA批准的新药类别及数量来看,在2010年前后发生了明显的变化。2010年之前,505(b)(1)占主导,2010年之后,505(b)(2)呈上升趋势,并逐渐赶超505(b)(1),2015年505(b)(2)以46:37的比例超过505(b)(1)。改良型新药已经成为全球新药研发的必不可少的一部分。
值得一提的是 “药械结合”的干粉吸入剂,具有广阔的市场前景,立志于创新的企业可以关注和挖掘。这个领域的产品开发技术难度高、投入大,而一旦成功,产品的市场独占期会很长,投资回报率也很高。
仿制药:高端仿制药快速发展
仿制药方面,最值得关注的是中国仿制药出口情况。最近几年,中国仿制药发展迅速。截至目前,中国共13家制药公司持有104个仿制药文号。此外,还有很多中国企业的ANDA正在申报中。药品出口类型也逐渐从单纯的API向高附加值的高端制剂转变。未来,中国企业的高端仿制药将迎来高速发展期。
【中国药企面临机遇】
“资金、技术、人才、政策”条件逐渐成熟
中国制药走上国际舞台
过去的10年里,全球医药行业内的合作与并购层出不穷,交易数量及交易额也逐渐呈上升趋势。
相比于并购成就的创新药巨头Pfizer,印度公司Jubilant则是并购造就的仿制药巨擘。Jubilant最初为印度的小型制剂研发型公司,年产值仅一两千万美元。从上世纪70年代开始,经过大大小小的30多次并购,Jubilant目前已经成为年收入10亿美元以上的大型跨国公司。其业务也从最初的仿制药,拓展到Biosimilar及创新药领域。
2015年,全球范围内围绕“仿制药”开展的合作交易共有1827宗,交易额高达3110亿美元。其中,已经完成或处于活跃状态的有1373宗,交易额1804亿美元。
从并购主体的国家及数量来看,美国公司最多,为568家。其次为中国,共308家。这一点,充分体现了中国制药企业积极拓展国际市场的勇气和决心,中国制药公司已经走上了国际舞台。
与发达国家的三个差距
虽然中国目前高端制剂出口正逐步创收,创新药研发也初具规模,但总体来讲,中国医药行业与发达国家相比差距还很大。主要体现在3个方面:
◎中国为制药大国,仍非制药强国。制药企业多,但利润率低,研发投入不足。
◎创新能力仍显薄弱。目前仍处于仿制为主到仿创结合的阶段,仿制药数量高达96%,创新药也多以me-too为主。
◎产研联盟作用虚化,缺乏有效机制体制和运作实体。
以2013年为例,排名前十的中国制药公司与国际制药公司相比,其销售额、利润、研发投入及成果转化率等相差甚远。
药审制度与全球接轨
值得庆幸的是,从全球药品注册的视野来看,中国与发达国家的药物研发审评体系正在加速接轨。
从2015年1月发布的《国际多中心药物临床试验指南(试行)》,到2015年4月份发布《中华人民共和国药品管理法》修订版,再到2015年7月22日开展的临床自查,一直到2016年颁布的新药品注册分类、仿制药一致性评价等法规新政,均体现了国家在解决审评积压、提高药品质量、鼓励创新等方面的决心。
结语
中国药企通过自主研发及海外并购等途径,已经走上了国际舞台。通过这些途径,已经初步积累了药物开发所必须的资金、技术、人才。随着法规新政的不断深入和完善,以及中国老百姓日益扩大的用药需求,中国药企也迎来了前所未有的机遇。







 相关新闻
相关新闻