本文中,小编整理了近年来DNA修复研究领域的重磅级成果,分享给大家!与大家一起学习!
【1】JCI:突破!科学家通过破坏细胞DNA修复的“跷跷板”来成功杀灭癌细胞
doi:10.1172/JCI92742
近日,一篇发表在国际杂志Journal of Clinical Investigation上的研究报告中,来自埃默里大学的研究人员通过研究发现,癌细胞依赖的一种免于细胞死亡的特殊蛋白或能帮助调节癌细胞的DNA修复。文章中,研究者阐明了如何使得这种名为Mcl-1的蛋白质失去功能来促进癌细胞对DNA复制压力变得更加敏感,靶向作用Mcl-1蛋白的化合物或许就能作为一类新型的抗癌药物。
文章中,研究者就发现了诸如上述化合物,实验结果表明,这种化合物能同当前已知的药物结合有效杀灭小鼠模型机体中的肺癌细胞。长期以来,研究人员一直知道Mcl-1蛋白在保护细胞免于程序性细胞死亡方面扮演着关键的角色,很多类型的癌细胞都会产生过量的Mcl-1蛋白。
通过仔细观察细胞循环周期中Mcl-1蛋白水平的上升和下降,研究人员就鉴别出了该蛋白的另一种特殊功能,如果细胞存在严重的DNA损伤,即DNA链发生断裂,细胞会有两种方式来尝试修复这种DNA损伤,其中一种就是从另外一个染色体复制正确的序列,该过程称之为同源重组;但这仅仅是在细胞进行染色体复制过程中才会发生,另外,细胞还会尝试将破损的DNA利用修剪和编织的方式重新组合在一起,该过程称之为非同源性末端接合(non-homologous end-joining,NHEJ),该过程通常效率较低,研究人员将细胞对
【2】Science:我国科学家解析出DNA修复关键组分Mec1-Ddc2的三维结构
doi:10.1126/science.aan8414
细胞不断地复制以便修复和替换受损组织,而且每次细胞分裂都需要复制DNA。 当DNA复制时,错误不可避免地发生,这会造成DNA损害,如果不加以修复的话,那么这可能导致细胞死亡。
作为DNA损伤的第一个线索,一种被称作ATR激酶的蛋白激活细胞的内在修复系统。如今,在一项新的研究中,来自中国科技大学、中科院分子细胞科学卓越创新中心和南京农业大学的研究人员以前所未有的分辨率解析出这种蛋白的结构图,并开始理解它对DNA损伤作出的反应。相关研究结果发表在2017年12月1日的Science期刊上,论文标题为“ 3.9 A structure of the yeast Mec1-Ddc2 complex, a homolog of human ATR-ATRIP”。
论文通信作者、中国科学技术大学生命科学博士生导师蔡刚(Gang Cai)教授说,“ATR蛋白是应对DNA损伤和复制应激(replication stress)的顶端激酶。长期以来,一个关键的问题是确定ATR激酶的激活机制---它如何对DNA损伤作出反应,以及它如何被激活。”
【3】Nature子刊:重大突破!利用CRISPR-Gold在体内诱导同源介导的DNA修复
doi:10.1038/s41551-017-0137-2
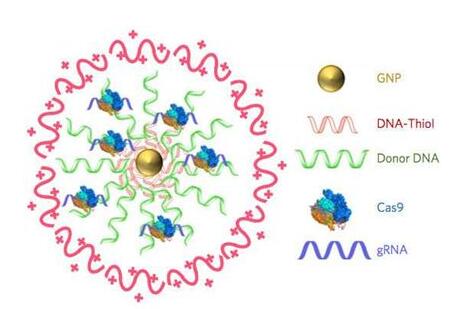
虽然很有前景,但是CRISPR-Cas9基因编辑的应用迄今为止因遭受运送挑战---也就是如何把所有的CRISPR组分提供给每个需要它们的细胞中---而受到限制。在一项新的研究中,来自美国加州大学伯克利分校、GenEdit公司和日本东京大学的研究人员通过注射一种他们称为CRISPR-Gold的载体,成功地修复杜兴氏肌肉营养不良(Duchenne muscular dystrophy)模式小鼠体内发生的抗肌营养不良蛋白(dystrophin)基因突变。CRISPR-Gold含有Cas9蛋白、向导RNA(gRNA)和供者DNA,它们都被包被在微小的金纳米颗粒周围。相关研究结果于2017年10月2日在线发表在Nature Biomedical Engineering期刊上,论文标题为“Nanoparticle delivery of Cas9 ribonucleoprotein and donor DNA in vivo induces homology-directed DNA repair”。
美国塔夫茨大学生物医学工程师Qiaobing Xu说,这些作者们“在基因编辑领域取得了巨大的进步。” Xu未参与这项研究,但是针对这项新的研究发表了一篇附随评论文章。Xu解释道,鉴于他们的方法是非病毒性的,这将使得因持续存在的Cas9活性而产生的潜在脱靶效应最小化。当利用病毒载体运送Cas9模板时,脱靶效应会发生。
【4】Nature:重大突破!揭示蛋白CYREN调节细胞选择DNA修复途径之谜
doi:10.1038/nature24023
是快速地做事情但会犯错误更好,还是做得慢些但做得完美更好呢?当决定选择如何修复DNA中的断裂时,细胞在两种主要的修复途径之间面临着同样的选择。这种决定比较重要,这是因为错误的决定可能导致更多的DNA损伤和癌症。
如今,在一项新的研究中,来自美国沙克生物研究所、加州大学圣地亚哥分校和英国弗朗西斯-克里克研究所的研究人员发现一种被称作CYREN的小分子蛋白协助细胞在合适的时间选择合适的修复途径,这就阐明了一个长期存在的关于DNA修复的谜团,并且为科学家们提供一种强大的工具,从而可能指导人们开发出更好的癌症疗法。相关研究结果于2017年9月20日在线发表在Nature期刊上,论文标题为“Regulation of DNA repair pathway choice in S and G2 phases by the NHEJ inhibitor CYREN”。
论文通信作者、沙克生物研究所分子与细胞生物学实验室教授Jan Karlseder说,“阐明DNA修复途径对理解它们有时如何对细胞产生伤害是至关重要的。我们关于CYREN功能的发现不仅增加了我们的知识,而且还给我们提供一种潜在抵抗癌症的新工具。”
【5】Science:重磅!揭示一种新的DNA损伤修复机制
doi:10.1126/science.aag1095 doi:10.1126/science.aan8293
DNA修复系统能够修复活性氧、活性羰基化合物、烷化剂、紫外线辐射、脱氧尿嘧啶整入和复制错误导致的DNA损伤。DNA修复机制包括核苷酸池消毒(nucleotide pool sanitization)、直接修复(DR)、碱基切除修复(BER)、核苷酸切除修复(NER)、错配修复(MMR)、同源重组修复(HRR)和非同源末端连接(NHEJ)。
糖化是体内的一种重要的DNA损伤来源,与增加的突变率和DNA链断裂相关联。在乙二醛(GO)和甲基乙二醛(MGO)的作用下,核酸发生永久性的糖化。作为糖代谢的副产物,GO和MGO在细胞中普遍存在,因而成为它们的主要的糖化试剂。对这些糖化试剂最为敏感的核苷酸是鸟苷酸(G)和脱氧鸟苷酸(dG)。确实,糖化鸟苷酸与DNA氧化损伤的主要产物---8-羟基脱氧鸟苷(8-oxo-dG)---一样比较普遍。尽管发生氧化的核苷酸,如8-oxo-dG,可通过鸟嘌呤氧化修复系统加以修复,但是迄今为止,人们并没有发现糖化核苷酸修复系统。
如今看来,基因DJ-1能够修复糖化核苷酸。在一项新的研究中,法国巴黎第七大学的Gilbert Richarme领导的一个研究团队报道DJ-1起着一种DNA去糖化酶(DNA deglycase)的作用,切除核酸中的额外糖分子。
【6】PNAS:科学家成功绘制出吸烟引发的DNA损伤修复障碍的图谱
doi:10.1073/pnas.1706021114
几十年来,科学家们早就已经知道吸烟能够引起DNA的损伤,进而引发肺癌的发生。如今,来自NUC医学院的科学家们首次描绘出了全基因组DNA损伤的高分辨率图谱。
这一创新性的研究是由来自UNC医学院的诺贝尔奖获得者Aziz Sancar博士领导作出的,相关结果发表在《PNAS》杂志上。Sancer等人开发出了一类描绘基因组损伤修复的图谱的方法,并通过该种方法检测了所有由致癌物'苯并芘'导致的基因组损伤的发生情况。据调查,美国境内30%的癌症死亡的病例是由该致癌物导致的。而这一图谱的绘制将帮助科学家们更好地理解吸烟对癌症发生的危害,并且对人群受影响程度的不同进行划分。
苯并芘'是一类简单的烃类化合物。科学家们认为该化合物是许多低等的碳基生物的存在基础,但对于人类等高级生物来说,这种分子反而具有负面的影响。苯并芘是有机物,例如烟草植物等,燃烧产生的副产物。一般情况下,有毒的烃类物质进入消化道或呼吸道中后,会被体内的酶降解以去除毒性,而苯并芘降解之后会生成一种叫做BPDE的化合物,这一物质的危害远大于苯并芘本身。
【7】Mol Cell:揭示出蛋白Rad52在RNA依赖性DNA修复中发挥关键性作用
doi:10.1016/j.molcel.2017.05.019
在一项新的研究中,来自美国德雷塞尔大学和佐治亚理工学院的研究人员发现同源重组蛋白Rad52如何在RNA依赖性的DNA修复中发挥着至关重要的作用。这一研究结果揭示出这种蛋白的一种令人吃惊的作用,并且可能有助鉴定出新的癌症治疗靶标。相关研究结果于2017年6月8日在线发表在Molecular Cell期刊上,论文标题为“Rad52 Inverse Strand Exchange Drives RNA-Templated DNA Double-Strand Break Repair”。论文通信作者为德雷塞尔大学医学院教授Alexander Mazin博士和佐治亚理工学院副教授Francesca Storici博士。Mazin和Storici一直致力于研究促进DNA修复的机制和蛋白。
放疗和化疗能够导致DNA双链断裂(最为有害的DNA损伤类型之一)。同源重组过程涉及在两个DNA分子之间交换遗传信息,在DNA修复中发挥着重要的作用,但是某些基因突变能够导致基因组失去稳定。比如,参与通过同源重组修复DNA损伤的肿瘤抑制基因BRCA2当发生突变时,能够导致致命性的乳腺癌和卵巢癌。
【8】Mol Cell:科学家揭示DNA断裂被修复的分子机制
doi:10.1016/j.molcel.2016.12.016
日前,一项刊登在国际杂志MolecularCell上的研究报告中,来自达姆施塔特工业大学的研究人员通过研究发现,修复DNA损伤的过程或许远比我们想象之中要复杂得多,DNA双链破碎的末端结构或许并不仅仅是加入进去那么简单,其首先会发生一种精细化地改变以便原来的遗传信息能够被储存起来。
DNA作为携带遗传信息的载体,其容易发生持续性地损伤,其中最严重的损伤就是DNA双链断裂,双螺旋结构就会被一分为二,如果细胞中类似的DNA损伤不能够被有消修复的话,重要的遗传信息就会出现缺失,这时候就会伴随细胞死亡的发生,或者诱发永久性的遗传改变以及细胞转化;随着人类机体进化,机体中修复DNA损伤的方法也会不断革新,在DNA损伤修复过程中很多酶类都会一起发挥作用来最大限度地恢复DNA中的遗传信息。
【9】Stem Cell Rep:抑制DNA修复蛋白或能帮助治疗恶性肿瘤
doi:10.1016/j.stemcr.2016.12.005
近日,一项刊登在国际杂志StemCellReports上的研究报告中,来自利兹大学的研究人员通过研究发现,靶向作用大脑中一种特殊的DNA修复蛋白或能对恶性脑瘤进行有效治疗,研究者表示,在实验室中抑制名为RAD51的蛋白质就能够帮助增加放疗杀灭胶质母细胞瘤的作用效率。
胶质母细胞瘤是成年人中一种常见的原发性脑瘤,同时这也是一种恶性脑瘤,尽管进行了多种治疗但很多患者经常会发生死亡。胶质母细胞瘤细胞亚群能够再生来进行复制,同时还会对疗法产生耐受性。在这项研究中,研究人员发现,名为胶质母细胞瘤干细胞(GSCs)的一类亚群细胞中含有较高水平的RAD51蛋白。
研究者SusanShort说道,放疗能够损伤胶质母细胞瘤细胞的DNA,但RAD51蛋白却会帮助细胞进行损伤DNA的修复,这就意味着其能够使肿瘤再度活化。利用抑制剂靶向作用RAD51蛋白研究者就能够使得GSCs对化疗变得敏感,从而就能够更加有效地移除肿瘤。目前研究者并不清楚胶质母细胞瘤细胞中RAD51蛋白水平增加从而能够对放疗产生耐受的机制,但本文研究中研究者就发现了能够靶向作用的合适蛋白,这就为后期开发新型疗法治疗胶质母细胞瘤提供了新的思路和希望。
【10】Nature子刊:组蛋白降解或能促进DNA的修复反应
doi:10.1038/nsmb.3347
日前,一项刊登在国际杂志NatureStructural&MolecularBiology上的研究报告中,来自瑞士巴塞尔弗雷德里希米歇尔生物医学研究所的研究人员通过研究揭开了组蛋白降解如何伴随DNA修复效应的产生。此前研究中研究者发现,当染色质的物理行为发生改变时就会导致DNA损伤,此时,双链断裂发生位点的运动就会增强,进而转变为高度的动态性;此外研究者还能够在和DNA损伤相对应的细胞核的未损伤位点中观察到相同的效应。
为了深入阐明这种现象发生的原因,研究者就通过研究发现,组蛋白能够从DNA上分离下来,而且大约30%的组蛋白能够在DNA损伤的情况下发生降解,而这种过程能够被所谓的检查点反应所控制,而且核小体密度的降低不仅能够增加DNA的可动性,还能够增加染色质进行重组介导修复的可能性。
DNA修复对于每个细胞和有机体都至关重要,如果缺少了DNA修复,蛋白就不会正常发挥作用,而且基因也会被错误调节,所有这些都会诱发疾病产生,因此细胞往往不惜一切代价来检测并且修复DNA的损伤,并且确保DNA的完整性。这项研究中研究者就通过研究发现,出现DNA损伤时,组蛋白降解或许会促进DNA的修复。









 相关新闻
相关新闻