CFDA及时通报同品种的评价进展,对于企业做出关键性选择至关重要。8月22日,CFDA发布了《关于企业开展289目录内仿制药质量和疗效一致性评价基本情况信息》,公布了当前“289目录”企业开展仿制药质量和疗效一致性评价(下称“一致性评价”)的基本情况。
整体来看,面临2018年底期限的289个品种中,绝大部分品种均已经有企业在开展一致性评价工作,仅有15个品种暂时无人问津。必须说,CFDA能够及时及时通报同品种的评价进展,对于当前企业做出关键性选择至关重要。
E药经理人梳理企业当前一致性评价的基本情况,同时为企业指出三大核心要点:一是竞争激烈的品种,企业需继续考量其选择;二是密切关注存在“消失”风险的品种,企业也可考虑把握其中机会;三是通过一致性评价的药品,能否在医保招标中获得与原研药同等的地位。
1、竞争最激烈的品种
从具体数字来看,同品种超过50家企业正在开展评价工作有17个品种,这些也均是市场上竞争激烈的品种。E药经理人统计了开展评价企业数量最多的10个品种(见表1),主要包括甲硝唑片、诺氟沙星胶囊、复方磺胺甲噁唑片以及阿莫西林胶囊等。
表1:289目录中竞争最激烈的10个品种
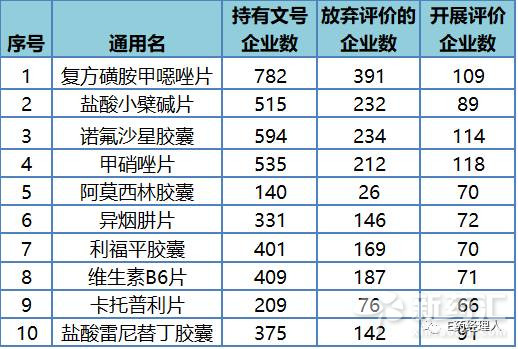
这些品种厂家数量较多,竞争激烈,但这种表现也与我国过去以抗生素、仿制药为主的产业结构有关。毕竟对于国内大多数传统制药企业,抗生素等常用仿制药仍然是他们业绩的重要支撑。 但根据相关政策要求,同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。因此,对于眼下这种上百家企业齐上赛道的情况,企业可能需要再次考量自己的战略选择,尤其是自己是否有实力、有能力在时间和技术上超越众多的竞争对手。
不得不提的是,虽然此次CFDA公布的是289目录的评价进展,但对于非289目录品种的相关企业来讲,也是一种提醒。虽然对于非289目录品种的评价时间,监管部门没有具体的时间限制,但“自第一家品种通过一致性评价后,3年后不再受理其他药品生产企业相同品种的一致性评价申请。”的激励政策使得企业提前布局显得愈加重要。
通常来说,企业优先进行一致性评价的均是自己的拳头产品,但眼下非289目录的产品一致性评价进展大多还处于“盲区”,即企业对于具体品种的评价的进展情况多是保密状态。对于正在积极开展或准备开展的制药企业而言,时间的竞争非常关键,同时企业也必须对自身产品情况和评价工作进展面临的形势有更加清晰的认识,才能做出了更加前瞻的决定。
2、部分品种面临“消失”风险
但对于监管部门来讲,这些竞争激烈的品种可能并非是他们最关注的对象,因为总有企业最终能够胜出。监管部门密切关注的应该是那些无人问津的品种,尤其是那些临床必需却少有企业开展一致性评价的品种。
根据目前CFDA公布的数据统计来看,在289目录中,仅3家企业在开展评价工作的品种有28个;仅2家开展评价工作的品种31个;仅一家开展评价工作的42个。还未有企业开展一致性评价的品种有15个(见表2)。
实际上,通常情况下,企业考虑成本产出比,会优先选择销量大、价格高的品种进行一致性评价。尤其在评价成本不断上升的形势下,低价和小品种药更容易被企业放弃,如此一些药品的断供风险就会进一步增大。
表2:289目录中暂无企业开展评价工作的15个品种
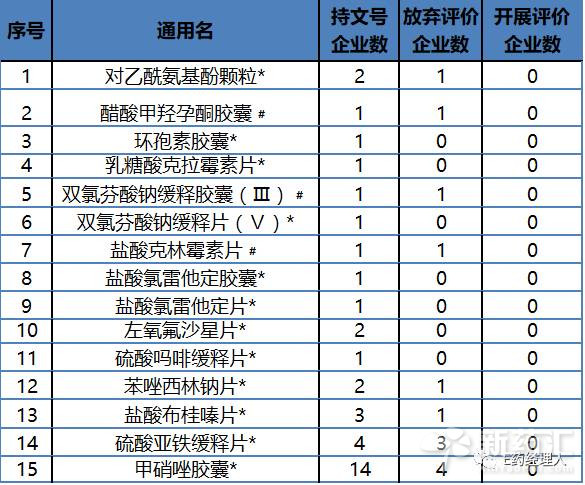
备注:“﹟”代表该品种企业暂时全部选择放弃; “*”代表该品种企业暂时选择不放弃,但未开展评价。
在CFDA发布的《关于仿制药质量和疗效一致性评价工作有关事项的公告》中明确规定:对由于通过一致性评价的生产企业数量少而影响市场供应的国家基本药物目录品种,由总局会同相关部委发布清单,鼓励企业研发申报仿制药。药品清单将根据品种一致性评价通过情况进行动态调整。
早前CFDA某官员也表示,对于评价进展缓慢,可能影响市场供应的品种,相关部门要加大资金和技术引导力度,确保临床用药的可及性。对于企业放弃的品种,会及时公布出来,并考虑列入临床短缺药目录,鼓励其他厂家仿制。
但目前来看,289目录中有相当一部分有品种存在在市场上“消失”的风险。目前开展评价企业数量小于等于3家的品种有116个,其中盐酸克林霉素片、双氯芬酸钠缓释胶囊、醋酸甲羟孕酮胶囊三个品种已经全部被企业放弃。
在笔者看来,对于这些品种,持有文号的企业可以考虑自身实际情况重新做出选择。而对于监管部门来讲,对于这些高风险品种,完备的应对方案极其重要,尤其是如何鼓励企业对这些产品进行仿制也需要继续探讨。
3、大概率将与原研同价报销
一年半以来,为推进企业开展仿制药一致性评价工作,CFDA投入了大量精力,陆续出台的政策文件是不断解决问题的过程。从目前CFDA公布的数据来看,一致性评价开展一年半以来,已取得较大进展,甚至可以说,其进程比预期的更快。
就参比制剂来说,289目录中,目前CFDA已发布了8批157个品种,未发布的主要是改剂型类的品种有80个,以及一些特有或特殊品种等。从最近消息来看,已有多家企业已经完成相关的技术评价工作。如不久前浙江省、江苏省已经先后发布公告,其省内一些企业如扬子江、京新药业等已完成部分品种的一致性评价。
接下来,业界的目光将聚焦于一致性评价品种的审批,以及后续能够在医保、招标的过程中获得相应的鼓励,实现真正的原研替代。
以医保而言,早前一致性评价政策指出,通过一致性评价的药品品种,将在医保支付方面予以适当支持。2017年以来,新的医保目录已经出台,但备受关注的医保支付标准却迟迟未能面世。那么,未来新医保支付标准将如何对待通过一致性评价的药品,是当前企业关心的重中之重。
据悉,在现行国家医保政策中,对仿制药和原研药是按同比例报销,原研药因价格高占用了超过一半的医保费用。早前行业人士建议,仿制药一致性评价实施后将仿制药与原研药同比例报销政策改为同额度报销。
近日,据相关部门某官员透露,新医保支付标准正在制定中,对通过仿制药一致性评价的品种将给予和原研同样的报销价格。这对于正在开展一致性评价的企业来讲,无疑是一则好消息。
同样,在当前的招标规则中原研药仍有其特殊地位。那么,通过一致性评价后,各地招采政策能否取消原研药价格保护,给予通过一致性评价的仿制药以和原研同等的地位,预计也将是接下来企业最关注,业界讨论最激烈的问题。









 相关新闻
相关新闻