4月28日,CFDA官网发布第三、第四批仿制药参比制剂目录,共涉及32个品种60个品规。
目前企业开展仿制药一致性评价的进度如何?下文通过备案参比制剂企业数超过30个的产品2017年生物等效性试验开展情况来进行分析。
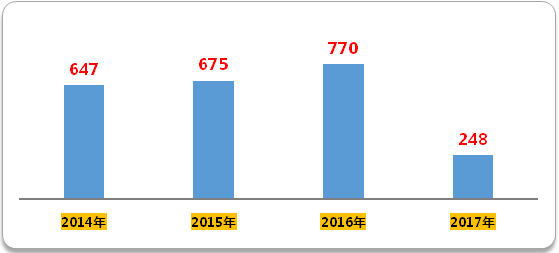
分析CDE药物临床试验登记与信息公示平台显示的数据可知,2016年临床试验登记号为770个,是三年来的新高。咸达数据V3.2发现,2017年前四个月(截至2017年4月25日,下同),临床试验登记号数达到248个,基本与往年持平。然而,从2015年CFDA共批准4573个受理号,2016年批准3666个受理号临床来看,批量获批临床的这些受理号,之后上临床的依然不多。
图1 2014年至今临床试验登记号
(数据来源:咸达数据V3.2)
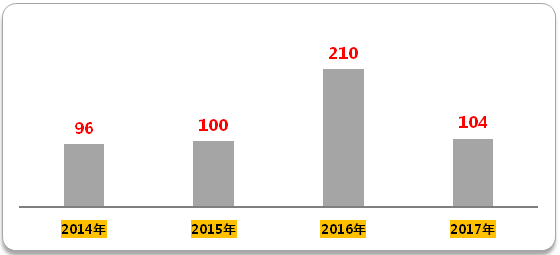
生物等效性(BE)试验方面,2016年开展的试验登记号210个,是2015年的两倍。2017年前四个月BE登记号数就已经104个,超越2015年全年。由此可见,临床申报积压解决之后,临床试验的竞争也随之开始。
2017年开展的104个生物等效性试验临床登记号中,有45个来自BE备案。这意味着备案制的执行,让后来申报者与此前积压排队申报者同时站在了一个时间起跑线上,鉴于此前积压排队的申报者未必按一致性评价要求完成项目,从而在申报生产竞争中处于劣势。
图2 2014年至今生物等效性试验登记号
(数据来源:咸达数据V3.2)
多数BE未启动,接盘谨慎
备案企业数超过30家的11个产品中,有8个未开展BE
咸达数据V3.2通过了解备案参比制剂企业数超过30个的产品2017年生物等效性试验开展情况来分析目前一致性评价的进度。
阿莫西林胶囊
阿莫西林胶囊是最多企业备案参比制剂的产品,超过50家企业对其进行备案。2017年终于有3家企业开展生物等效性试验,分别是桂林南药股份有限公司、石药集团中诺药业(石家庄)有限公司和珠海联邦制药股份有限公司中山分公司。这3家都是通过BE备案申报开展的,目前进度都是招募中。
奥美拉唑肠溶胶囊
作为2018年年底必须完成一致性评价289个品种之一,奥美拉唑肠溶胶囊有近50家企业对其进行备案,但是暂无企业开展生物等效性试验。
盐酸二甲双胍片
盐酸二甲双胍片也是289个品种之一,也有近50家企业对其进行备案。2016年石药集团欧意药业有限公司已开展生物等效性试验,目前试验已完成。2017年北京四环制药有限公司通过BE备案开展试验,目前进度招募中。
盐酸雷尼替丁胶囊
盐酸雷尼替丁胶囊共48家企业对其备案,也属于289个品种之一,目前也无企业对其开展生物等效性试验。
辛伐他汀片、甲硝唑片
辛伐他汀片和甲硝唑片都在289品种名单之中,都有近40家企业对其进行备案,都没企业在2015年以后开展生物等效性试验。
苯磺酸氨氯地平片
超过30家企业备案苯磺酸氨氯地平片。2015年10月,北京天衡药物研究院南阳天衡制药厂开展苯磺酸氨氯地平片生物等效性试验,目前进度为“已完成”。2016年,长春海悦药业有限公司、扬子江药业集团上海海尼药业有限公司和西安葛蓝新通制药有限公司3家开展生物等效性试验,其中扬子江药业集团上海海尼药业有限公司是BE备案。2017年,仅江苏黄河药业股份有限公司1家通过BE备案开展生物等效性试验。以上2016年以后开展的试验目前进度未有超过招募阶段的。
头孢拉定胶囊、头孢氨苄胶囊、阿奇霉素片和诺氟沙星胶囊
289品种名单之中的头孢拉定胶囊、头孢氨苄胶囊、阿奇霉素片和诺氟沙星胶囊,都有超过30家企业备案,都暂未有企业开展生物等效性试验。
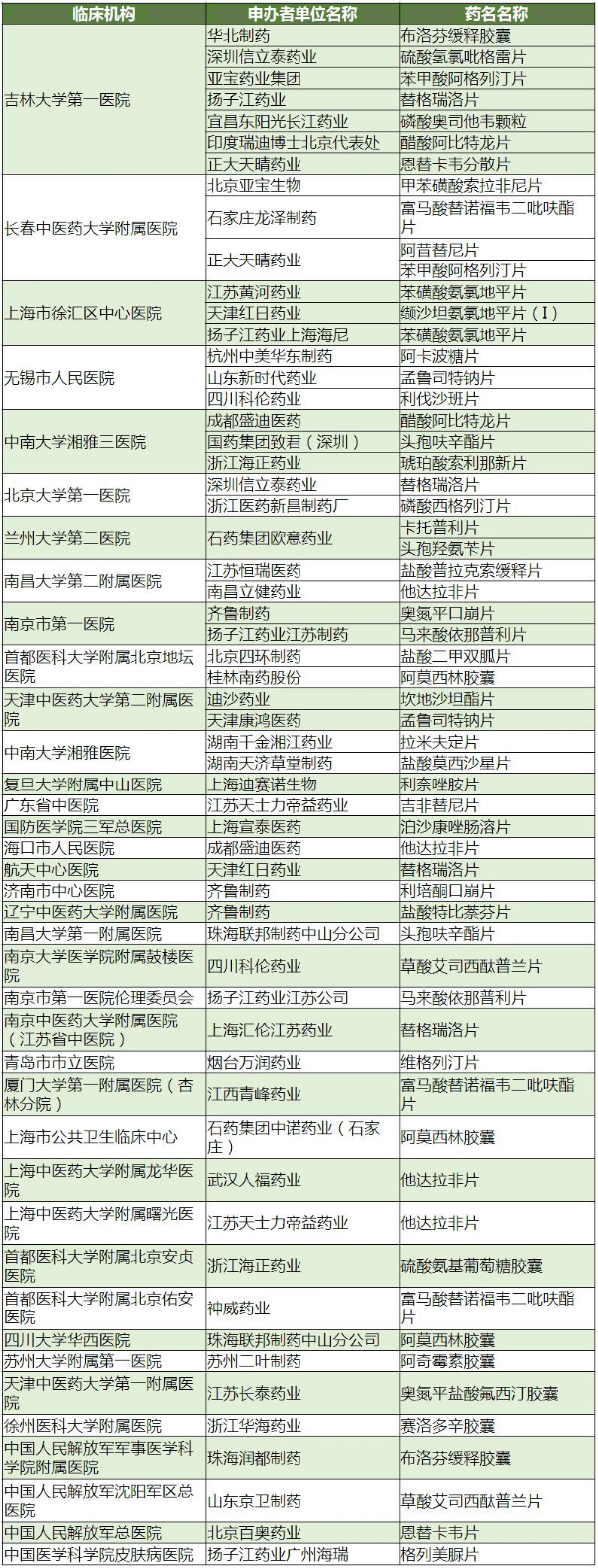
从表1所示,阿莫西林胶囊、盐酸二甲双胍片和苯磺酸氨氯地平片试验开展的医院中,首都医科大学附属北京地坛医院和上海市徐汇区中心医院分别以2个项目排第一,其中上海市徐汇区中心医院同时接收1个产品不同企业的项目。
表1 阿莫西林胶囊、盐酸二甲双胍片和苯磺酸氨氯地平片
(数据来源:咸达数据V3.2)
小结
参比制剂备案企业数超过30家的产品共11个,只有3个产品在2015年以后有企业开展生物等效性试验,未开展的8个产品都在289目录名单中。由此可以推测,289品种目前一致性评价的进度大多数还没进入临床阶段。
2015年和2016年获批的项目中,有不少是科技公司的仿制药项目。MAH制度后,在试点城市的科技公司可以自行启动项目,大多数项目最终还是要和生产企业合作。临床项目启动数量较少,从侧面来看反应了BE临床试验成本上升后,下游企业投资趋谨慎。最终能启动的项目都是实力较强以往信誉度较高的科技公司名下的。
BE备案项目对应的临床机构
主要集中在北、上、江、吉,个别机构承接项目较多
2016年以后,咸达数据V3.2发现,通过BE备案进行生物等效性临床试验的登记号共70个,其中齐鲁制药有限公司的产品数最多,共三个,分别为奥氮平口崩片、利培酮口崩片和盐酸特比萘芬片。
70个BE备案产品主要在38个临床机构中开展试验,其中吉林大学第一医院是最受欢迎的医院,共7个厂家产品在其开展生物等效性试验。长春中医药大学附属医院排第二,共4个厂家产品在其开展生物等效性试验。上海市徐汇区中心医院、无锡市人民医院和中南大学湘雅三医院并列第三。
进一步分析发现,2016年以后吉林大学第一医院开展的生物等效性试验的登记号48个,长春中医药大学附属医院13个,上海市徐汇区中心医院7个,无锡市人民医院6个,中南大学湘雅三医院8个。
小结
从临床机构而言,承接的临床机构主要分布在北京、上海、江苏、吉林,仿制药批文号较多的广东承接的临床机构较少。个别临床机构承接的项目数较多。
表2 70个备案BE对应的临床机构
(数据来源:咸达数据V3.2)
仿制药参比制剂目录(第三批)
仿制药参比制剂目录(第四批)










 相关新闻
相关新闻