
CDE药品审评周报(2015.6.28-2015.7.4)
CDE药品审评周报(2015.6.28-2015.7.4)
本周(2015.6.28-2015.7.4)有83个药品(按受理号计)进入在审评状态,其中78个化药,3个中药,2个预防用生物制品。
重点如下:
1.盐酸亚格拉汀胶囊:本品是亚宝药业与礼来制药合作开发的一种新型降糖药,与现有降糖药相比,其具有双重降糖机制:促进胰岛素的分泌和减少肝脏葡萄糖的输出。即使是在服用其它口服降糖药无效的糖尿病患者身上,盐酸亚格拉汀仍可能会发挥强大的降糖作用。目前本品已在美国进行II期临床试验。
2.SC10914片:本品是一种PARP抑制剂,由江西青峰制药开发。PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而可增强放疗以及烷化剂和铂类药物化疗的疗效。目前上市的PARP抑制剂主要为阿斯利康的奥拉帕尼。
3.复方卡格列净盐酸二甲双胍片:本品由哈尔滨珍宝制药3.2类申报,为国内唯一申报此降糖复方的企业。复方卡格列净盐酸二甲双胍片是卡格列净的复方制剂,由杨森制药开发,已先后获得EMA和FDA的批准。
在审批
本周共9个药物进入审批程序,均为化药。重点如下:
1.SHR4640片:恒瑞医药开发的1.1类新药,本品为一种URAT1抑制剂,用于治疗痛风。2014年3月申报,为特殊审评品种,2015年4月发补一次,目前已审评完毕,获批临床。
在审批的药物信息见附图1。
审批完毕
本周有2个药物审批完毕,均为山东罗欣药业的苯甲酸阿格列汀片(CXHL1200404、CXHL1200405),已在具体进度中看到“不批准”公告。
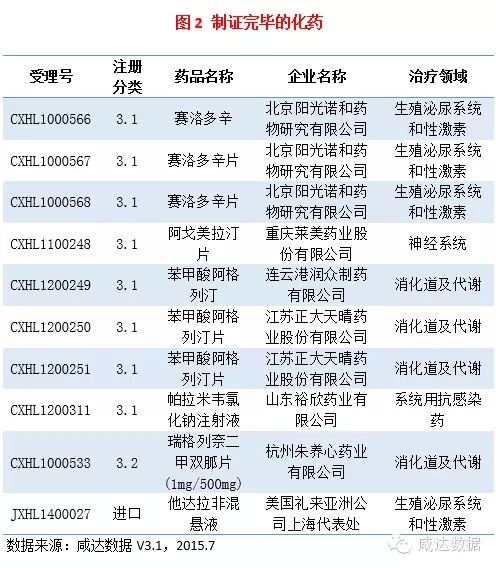
制证完毕
本周制证完毕的药物共12个,其中10个药化,1个中药,1个治疗用生物制品。其中,江苏正大天晴药业股份有限公司的苯甲酸阿格列汀及片剂、重庆莱美药业股份有限公司的阿戈美拉汀片、以及杭州朱养心药业有限公司的瑞格列奈二甲双胍片(1mg/500mg)均获批临床。此外,美国礼来亚洲公司上海代表处的他达拉非混悬液,在具体进度中看到“不批准”公告。
制证完毕的化药见附表2。
本周(2015.6.28-2015.7.4)有83个药品(按受理号计)进入在审评状态,其中78个化药,3个中药,2个预防用生物制品。
重点如下:
1.盐酸亚格拉汀胶囊:本品是亚宝药业与礼来制药合作开发的一种新型降糖药,与现有降糖药相比,其具有双重降糖机制:促进胰岛素的分泌和减少肝脏葡萄糖的输出。即使是在服用其它口服降糖药无效的糖尿病患者身上,盐酸亚格拉汀仍可能会发挥强大的降糖作用。目前本品已在美国进行II期临床试验。
2.SC10914片:本品是一种PARP抑制剂,由江西青峰制药开发。PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而可增强放疗以及烷化剂和铂类药物化疗的疗效。目前上市的PARP抑制剂主要为阿斯利康的奥拉帕尼。
3.复方卡格列净盐酸二甲双胍片:本品由哈尔滨珍宝制药3.2类申报,为国内唯一申报此降糖复方的企业。复方卡格列净盐酸二甲双胍片是卡格列净的复方制剂,由杨森制药开发,已先后获得EMA和FDA的批准。
在审批
本周共9个药物进入审批程序,均为化药。重点如下:
1.SHR4640片:恒瑞医药开发的1.1类新药,本品为一种URAT1抑制剂,用于治疗痛风。2014年3月申报,为特殊审评品种,2015年4月发补一次,目前已审评完毕,获批临床。
在审批的药物信息见附图1。
审批完毕
本周有2个药物审批完毕,均为山东罗欣药业的苯甲酸阿格列汀片(CXHL1200404、CXHL1200405),已在具体进度中看到“不批准”公告。
制证完毕
本周制证完毕的药物共12个,其中10个药化,1个中药,1个治疗用生物制品。其中,江苏正大天晴药业股份有限公司的苯甲酸阿格列汀及片剂、重庆莱美药业股份有限公司的阿戈美拉汀片、以及杭州朱养心药业有限公司的瑞格列奈二甲双胍片(1mg/500mg)均获批临床。此外,美国礼来亚洲公司上海代表处的他达拉非混悬液,在具体进度中看到“不批准”公告。
制证完毕的化药见附表2。


分享到:









 相关新闻
相关新闻